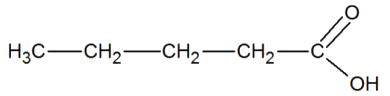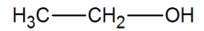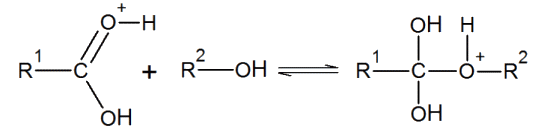|
Les esters ont des arômes souvent agréables et fruités, et sont utilisés dans l’industrie alimentaire pour reproduire des arômes de fruits. Leur synthèse, qui nécessite l’utilisation d’un alcool et d’un acide carboxylique, est généralement facile à réaliser en laboratoire.
Présentation de la réaction d’estérification
L'estérification est une réaction chimique permettant de former un ester à partir d’un acide carboxylique et d’un alcool. En se plaçant dans un cas général, si l’acide carboxylique a pour formule R1—CO2H et l’alcool R2—OH, alors l’ester formé sera R1—CO2—R2 selon la réaction d’équation :

R1 et R2 sont des groupements alkyles.
Données :
| H | C | O |
| Numéro atomique Z | 1 | 6 | 8 |
| Masse molaire atomique M (en g·mol-1) | 1,0 | 12,0 | 16,0 |
| Électronégativité (Échelle de Pauling) | 2,1 | 2,5 | 3,5 |
Bandes d’absorption caractéristiques en IR
| Liaison | Nombre d’onde (cm-1) | Intensité |
| O-H (alcool) | 3200 à 3400 | forte, large |
| O-H (acide carboxylique) | 2500 à 3200 | forte à moyenne, large |
| C-H , carbone tétraédrique | 2800 à 3000 | forte |
| C=O | 1650 à 1750 | forte |
| C-O | 1050 à 1450 | forte |
Partie 1 : étude du mécanisme réactionnel de la réaction d’estérification
On s’intéresse à la réaction de formation d’un ester à partir d’acide pentanoïque et d’éthanol.
| Acide pentanoïque | C5H10O2 | 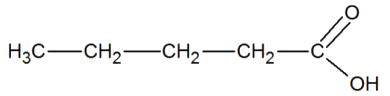 |
| Ethanol | C2H6O | 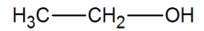 |
1.1. Écrire l’équation de la réaction de cette synthèse en utilisant les formules topologiques des espèces mises en jeu.
1.2. Le spectre infrarouge du produit obtenu après extraction est présenté ci-dessous. Quelles informations sur ce spectre permettent de savoir si la réaction a bien eu lieu ?
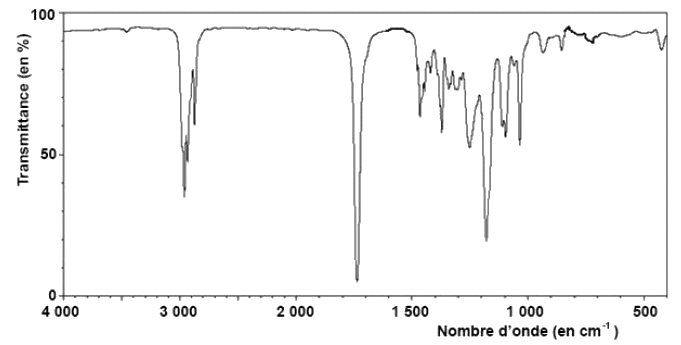
Source : sdbs, septembre 2016
1.3. La réaction présente un mécanisme réactionnel, en plusieurs étapes. L’une des étapes est représentée ci-dessous :
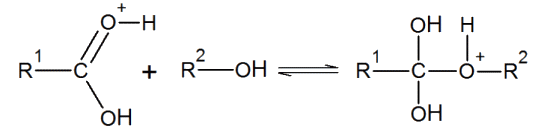
1.3.1. Reproduire cette étape sur la copie. Ajouter les doublets non liants manquants et représenter la (les) flèche(s) courbe(s) rendant compte de cette étape.
1.3.2. À quelle catégorie de réaction appartient cette étape ?
Partie 2 : réalisation de la synthèse de l’arôme d’ananas
La synthèse de l'arôme d'ananas a été réalisée au laboratoire mais il manque des informations dans le cahier de laboratoire. Les quantités de réactifs utilisés pour être dans les proportions stœchiométriques sont indiquées mais la nature des réactifs n'est pas précisée.
Réactifs présents au laboratoire
| Nom | Formules chimiques | Caractéristiques physiques | Pictogrammes |
Acide
propanoïque | C3H6O | M = 74,1 g·mol-1
d = 0,99 | Tfusion : -21,0°C
Tébullition : 141°C |  |
Acide
butanoïque | C4H8O2 | M = 88,0 g·mol-1
d = 0,96 | Tfusion : -7,9°C
Tébullition : 164°C |  |
| Ethanol | C2H6O | M = 46,0 g·mol-1
d = 0,79 | Tfusion : -117°C
Tébullition : 79°C |  |
Acide sulfurique
concentré | H2SO4 | M = 98,1 g·mol-1
d = 1,83 | |  |
Extrait du cahier de laboratoire
- Dans un ballon de 150 mL, afin d’être dans des proportions stœchiométriques, introduire 10,5 mL d’alcool et 16,5 mL d’acide carboxylique.
- Ajouter quelques gouttes d’acide sulfurique concentré et agiter le milieu réactionnel.
- Faire chauffer à reflux pendant 30 minutes.
Après avoir été synthétisé, l’ester est isolé.
2.1. À l’aide des notes prises sur le cahier de laboratoire et des réactifs à disposition, déterminer l’acide carboxylique utilisé.
Pour cette question, le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
2.2. Indiquer les précautions à prendre lors du prélèvement des réactifs. Justifier.
2.3. Pourquoi chauffe-t-on à reflux ?
|