Carnet de cours
Chimie organique
26. Nomenclature |
||||||||||||||||||||||||||||||
| Écriture de la formule d'une molécule | ||||||||||||||||||||||||||||||
| • La formule brute d'une molécule indique la nature et la quantité de chaque atome qui la constitue. | ||||||||||||||||||||||||||||||
| • La formule développée indique la nature des atomes et leurs liaisons. | ||||||||||||||||||||||||||||||
| • La formule semi-développée indique la nature des atomes et n'indique pas les liaisons C-H. | ||||||||||||||||||||||||||||||
| • La formule topologique n'indique ni les atomes de carbone ni les liaisons C-H. | ||||||||||||||||||||||||||||||
Représentations de Lewis et de Cram |
||||||||||||||||||||||||||||||
| • La représentation de Lewis rend compte de la répartition des électrons au sein d'une molécule. | ||||||||||||||||||||||||||||||
| - liaison de covalence : tiret entre les deux atomes liés | ||||||||||||||||||||||||||||||
| - doublet non-liant (ou libre) : tiret sur l'atome qui le porte | ||||||||||||||||||||||||||||||
| • Les atomes d'une molécule dite linéaire sont répartis selon une seule direction de l'espace. Les atomes d'une molécule dite plane sont répartis selon deux directions de l'espace. Les atomes d'une molécule dite spatiale sont répartis dans les trois directions de l'espace. | ||||||||||||||||||||||||||||||
| • La représentation de Cram rend compte de la géométrie d'une molécule selon la convention suivante : | 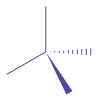 |
|||||||||||||||||||||||||||||
| - liaison dans le plan de la feuille : trait plein | ||||||||||||||||||||||||||||||
| - liaison en avant : triangle | ||||||||||||||||||||||||||||||
| - liaison en arrière : triangle en tirets | ||||||||||||||||||||||||||||||
| Géomètrie de l'atome de carbone | ||||||||||||||||||||||||||||||
| Un C formant des liaisons simples a une géométrie spatiale. | ||||||||||||||||||||||||||||||
| Un C formant une liaison double a une géométrie plane. | ||||||||||||||||||||||||||||||
| Un C formant une liaison triple a une géométrie linéaire. | ||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Chaîne carbonée |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Isomérie |
||||||||||||||||||||||||||||||
| • Deux molécules différentes sont isomères si elles ont une même formule brute. | ||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
• Si deux carbones sont liés par une liaison double et portent chacun deux substituants différents alors on distingue la configuration Z et la configuration E : - la configuration est de type Z (zusammen = ensemble) si les substituants de plus grand numéro atomique sont situés du même coté de l'axe de la liaison double. - la configuration est de type E (entgegen = opposé) si les substituants de plus grand numéro atomique sont situés de part et d'autre de l'axe de la liaison double. | ||||||||||||||||||||||||||||||
| • On dit qu'un mélange est racémique s'il est composé à égalité de chaque énantiomère. | ||||||||||||||||||||||||||||||
Chiralité et carbone asymétrique |
  |
|||||||||||||||||||||||||||||
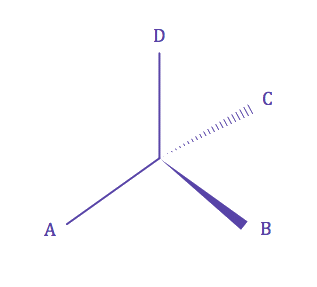
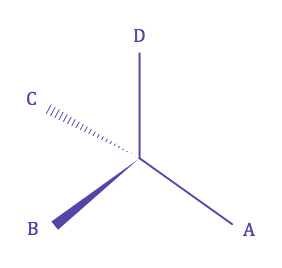
| • Une molécule est dite chirale (χειρ = main) si elle n'est pas superposable à son image dans un miroir. | ||||||||||||||||||||||||||||||
| • Un carbone est dit asymétrique et noté C*, s'il est lié de manière tétraédrique à quatre substituants différents. | ||||||||||||||||||||||||||||||
| Chiralité d'une molécule | ||||||||||||||||||||||||||||||
| D'après les définitions de la chiralité et d'un carbone asymétrique, une molécule possédant un carbone assymétrique est chirale. | ||||||||||||||||||||||||||||||
| D'après la définition de l'énantiomèrie, une molécule chirale et son image dans un moiroir sont énantiomères entre elles. | ||||||||||||||||||||||||||||||
27. Groupes fonctionnels |
||||||||||||||||||||||||||||||||||||||||||||
| Hydrocarbure : alcane, alcène, alkyle | ||||||||||||||||||||||||||||||||||||||||||||
| • Un hydrocarbure est une molécule constituée uniquement d'atomes de carbone et d'hydrogène. | ||||||||||||||||||||||||||||||||||||||||||||
| • Un hydrocarbute est dit saturé s'il ne contient que des liaisons simples, et insaturé s'il contient au moins une liaison double ou triple. | ||||||||||||||||||||||||||||||||||||||||||||
| • Un alcane est un hydrocarbure constitué uniquement de liaisons simples. On le nomme avec le suffixe ane. | \(\displaystyle \mathrm{ -C-C- }\) | |||||||||||||||||||||||||||||||||||||||||||
| • Un alcène est un hydrocarbure constitué d'au moins une double liaison carbone-carbone. On le nomme avec le suffixe ène. | \(\displaystyle \mathrm{ -C=C- }\) | |||||||||||||||||||||||||||||||||||||||||||
| • Un alkyle est une ramification hydrocarbonée. | ||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
Groupe hydroxyle, fonction alcool |
||||||||||||||||||||||||||||||||||||||||||||
| • Un groupe hydroxyde est un assemblage | \(\displaystyle \mathrm{ - \ OH }\) | |||||||||||||||||||||||||||||||||||||||||||
| • Un alcool est une molécule portant au moins un groupe hydroxyle porté par un carbone tétraédrique, nommée par le suffixe ol. | ||||||||||||||||||||||||||||||||||||||||||||
| • Un alcool est dit primaire si le carbone portant le groupe hydroxyle n'est lié qu'à un unique autre atome de carbone. | R ─ CH2 ─ OH | |||||||||||||||||||||||||||||||||||||||||||
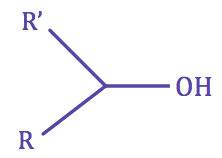
| • Un alcool est dit secondaire si le carbone portant le groupe hydroxyle est lié à deux autres atomes de carbone. |
|
|||||||||||||||||||||||||||||||||||||||||||
| • Un alcool est dit tertiaire si le carbone portant le groupe hydroxyle est lié à trois autres atomes de carbone. |
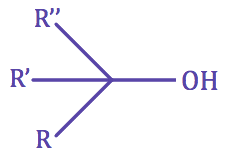
|
|||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
Groupe carbonyle, fonctions aldéhyde et cétone |
||||||||||||||||||||||||||||||||||||||||||||
| • Un groupe carbonyle est un assemblage | \(\displaystyle \mathrm{ - \ C=O }\) | |||||||||||||||||||||||||||||||||||||||||||
| • Un aldéhyde (alcool deshydrogenatum) est une molécule dont le carbone portant le groupe carbonyle porte aussi 1 ou 2 H, nommée par le suffixe al. | \(\displaystyle \mathrm{ R-CH=O }\) | |||||||||||||||||||||||||||||||||||||||||||
| • Une cétone est une molécule dont le carbone portant le groupe carbonyle ne porte aucun H, nommée par le suffixe one. | \(\displaystyle \mathrm{ R-C=0 }\) | |||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
Groupe carboxyle, fonctions acide et ester |
||||||||||||||||||||||||||||||||||||||||||||
| • Un groupe carboxyle est un assemblage | \(\displaystyle \mathrm{ -COOH }\) | |||||||||||||||||||||||||||||||||||||||||||
| • Un acide carboxylique est une molécule portant un groupe carboxyle, nommée par le suffixe oïque. | \(\displaystyle \mathrm{ R-COOH }\) | |||||||||||||||||||||||||||||||||||||||||||
| • Un ester carboxylique est une molécule dérivant d'un acide carboxylique et portant un groupe -COO- , nommée par le préfixe oate et le suffixe yle. | \(\displaystyle \mathrm{ R-COO-R' }\) | |||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
Groupes azotés, fonctions amine et amide |
||||||||||||||||||||||||||||||||||||||||||||
| • Un groupe amine est un assemblage azoté | ||||||||||||||||||||||||||||||||||||||||||||
| • Une amine est dite primaire si l'azote porte 2 H | \(\displaystyle \mathrm{ R-NH_2 }\) | |||||||||||||||||||||||||||||||||||||||||||
| • Une amine est dite secondaire si l'azote porte 1 H |
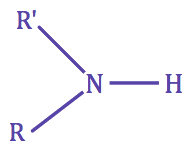
|
|||||||||||||||||||||||||||||||||||||||||||
| • Une amine est dite tertiaire si l'azote ne porte aucun H |
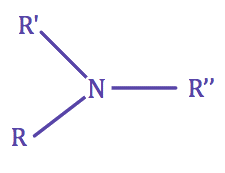
|
|||||||||||||||||||||||||||||||||||||||||||
| • Un acide α-aminé est un acide carboxylique comportant une ramification NH2 en position α | \(\displaystyle \mathrm{ R-C(NH_2)COOH }\) | |||||||||||||||||||||||||||||||||||||||||||
| • Un groupe amide est un assemblage | \(\displaystyle \mathrm{ N-C=O }\) | |||||||||||||||||||||||||||||||||||||||||||
| • Un amide est une molécule portant un groupe amide. | ||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
28. Mécanismes réactionnels |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Site donneur et site accepteur d'électrons | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • Un site est dit donneur s'il est susceptible de céder un doublet d'électrons. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • Un site est dit accepteur s'il est susceptible de capter un doublet d'électrons. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
• On appelle charge partielle, notée δ ⊕ si elle est positive et δ ⊝ si elle est négative, la charge d'un site résultant de la différence d'électronégativité entre deux atomes formant une liaison de covalence. |
δ ⊕ ___________ δ ⊝ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Transfert de doublet électronique |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • On représente un transfert de doublet d'électrons par une flêche issue d'un doublet d'électrons du site donneur et pointant vers un site accepteur. |  |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Addition, substitution, élimination |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • Une réaction d'addition est une réaction au cours de laquelle on ajoute un atome ou un groupe d'atomes à une molécule. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • Une réaction de substitution est une réaction au cours de laquelle on remplace un atome ou un groupe d'atomes par un autre au sein d'une molécule. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • Une réaction d'élimination est une réaction au cours de laquelle on ôte un atome ou un groupe d'atomes à une molécule. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • On appelle étape, un mécanisme réactionnel élémentaire pouvant mettre en jeu un ou plusieurs transferts de doublets d'électrons au sein d'une molécule ou entre deux molécules. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
29. Extraction et synthèse |
||||||||||||||||||||||||||||||||||||||||||||
| Extraction | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle extraction un protocole expérimental permettant la séparation et l'isolement d'une espèce chimique initialement présente au sein d'un mélange. | ||||||||||||||||||||||||||||||||||||||||||||
| • On dit d'un mélange qu'il est homogène si l'on ne peut distiguer à l'œil nu les différentes parties qui les constituent. Dans le cas contraire, le mélagne est dit hétérogène. | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle décantation le procédé par lequel on sépare les constituants solides du liquide dans lequel ils se trouvent en les laissant s'accumuler sous l'effet de leur propre poids en bas du récipient. | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle distillation simple le procédé par lequel on sépare deux liquides en vertu de la différence de leur températures d'ébullition. | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle distillation fractionnée une distillation améliorée à l'aide d'une colonne de vigreux. | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle hydrodistillation ou entraînement à la vapeur, une distillation dont l'un des composants est l'eau. | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle miscibilité de deux liquides, la capacité de ces deux liquides à se mêler en un mélange homogène. | ||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
Synthèse |
||||||||||||||||||||||||||||||||||||||||||||
| • On dit d'une espèce qu'elle est naturelle si elle a été extraite d'un produit existant dans la nature ; artificielle si elle existe dans la nature mais a été synthétisée artificiellement ; synthétique elle a été synthètisée artificiellement et n'a pas d'équivalent dans la nature. | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle synthèse un protocole expérimental permettant la production artificielle d'une espèce chimique. | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle substrat la substance qu'on souhaite transformer en la faisant réagir avec les autres réactifs. | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle brut réactionnel l'ensemble des espèces présentes en fin de réaction. | ||||||||||||||||||||||||||||||||||||||||||||
| • On dit qu'un réactif est non-sélectif s'il agit indifféremment sur toutes les fonctions organiques d'un substrat. On dit qu'il est sélectif s'il agit préférentiellement sur certaines fonctions. | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle protection de fonction le procédé par lequel la réactivié d'une fonction avec un réactif est neutralisée momentanément en vue de privilégier la réaction du réactif avec les autres fonctions du substrat. | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle recritallisation le procédé par lequel on purifie un composé solide contenant des impuretés dont la solubilité est différente à chaud et à froid. | ||||||||||||||||||||||||||||||||||||||||||||
| • L'utilisation atomique ou économie d'atome notée UA ou EU, d'une synthèse est le rapport entre la masse molaire du produit recherché et la somme des masses molaires des réactifs de la réaction pondérée par les nombres stœchiométriques correspondants. | \(\displaystyle\mathrm{ UA=\frac{ M (produit \ recherché)}{\sum n_i \ M_i (réactif) } }\) | |||||||||||||||||||||||||||||||||||||||||||
Rendement |
||||||||||||||||||||||||||||||||||||||||||||
| • On définit le rendement, noté η et mesuré sans unité (ou en pourcentage), d'une extraction ou d'une synthèse, le rapport entre la quantité d'espère obtenue n et la quantité maximale théorique nmax susceptible d'être obtenue | \(\displaystyle\mathrm{ η=\frac{n}{n_{max}} }\) | |||||||||||||||||||||||||||||||||||||||||||
| Rendement en fonction des masses | ||||||||||||||||||||||||||||||||||||||||||||
| D'après la définition du rendement on montre qu'il peut s'écrire en fonction de la masse obtenue m et de la masse maximale théorique mmax susceptible d'être obtenue. | \(\displaystyle\mathrm{ η=\frac{m}{m_{max}} }\) | |||||||||||||||||||||||||||||||||||||||||||
Identification |
||||||||||||||||||||||||||||||||||||||||||||
| • On appelle réfractomètre un appareil permettant d'identifier un liquide par la mesure de son indice de réfraction. | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle banc Kofler un appareil permettant d'identifier un solide par la mesure de son point de fusion. | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle tube de Thièle un appareil permettant d'identifier un solide par la mesure de son point de fusion. | ||||||||||||||||||||||||||||||||||||||||||||
| • On appelle chromatographie la technique de séparation de plusieurs espèces présentes à l'état liquide au sein d'un mélange en vue d'identifier ces espèces par comparaison de leurs migrations avec celles de susbtances connues. | ||||||||||||||||||||||||||||||||||||||||||||
| • Une chromatographie met en œuvre une phase dite stationnaire et une phase dite mobile appelée éluant. On distingue les chromatographies sur couche mince (dites aussi CCM) et les chromatographies sur papier. | ||||||||||||||||||||||||||||||||||||||||||||
30. Analyse spectrale |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Absorption par transition, vibration et rotation | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • La transmitance, notée T et mesurée sans unité, associée à des flux de lumière incident Φi et transmis Φt s'écrit | \(\displaystyle\mathrm{ T=\frac{Φ_t}{Φ_i} }\) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • L'absorbance, notée A et mesurée sans unité, associée à la transmitance T s'écrit | \(\displaystyle\mathrm{ A = - \ log \ T }\) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Loi de Beer-Lambert | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Il existe un coefficient ελ appelé coefficient d'extinction tel que | \(\displaystyle\mathrm{ A_{λ} = ε_{λ} \ ℓ \ [X] }\) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Nombre d'onde et bande caractéristique |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • Le nombre d'onde, noté σ et mesuré en cm-1, est l'inverse de la longueur d'onde | \(\displaystyle\mathrm{ σ=\frac{1}{λ} }\) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • On appelle bande caractéristique d'un groupe caractéristique, l'ensemble des radiations absorbées par le groupe caractéristique concerné. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Résonance magnétique nucléaire du proton (RMN) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • On appelle technique de résonance magnétique nucléaire du proton la technique permettant d'identifier la présence et l'emplacement des atomes d'hydrogène dans une molécule. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • Le déplacement chimique, noté δ et mesuré sans unité ou en ppm (partie par million), s'écrit | \(\displaystyle\mathrm{ δ = \frac{( ν - ν_{ref}) }{ν_0} 10^6 }\) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ν est la fréquence de résonance du proton | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| νref est la fréquence de résonance des protons du tétraméthylsilane (TMS) : Si(CH3)4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ν0 est une fréquence dépendant du champ magnétique dans lequel est placé l'échantillon analysé. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • Deux atomes d'hydrogène sont dits équivalents s'ils sont liés à des enchaînements d'atomes identiques. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • On appelle massif un signal apparaissant sur un spectre RMN. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • On appelle multiplicité le nombre le pics dans un massif : | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| • On appelle courbe d'intégration la courbe rendant compte du nombre de noyaux d'hydrogène présentant le même dépalcement chimique. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

