|

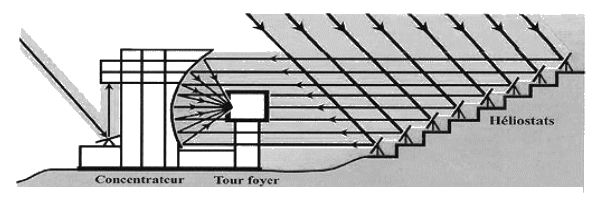
Perché à 1535 m d’altitude, le "Grand Four Solaire" d'Odeillo est un laboratoire de recherche du CNRS (centre national de la recherche scientifique). D’une puissance de 1000 kW au foyer, il est à ce jour le four solaire le plus puissant au monde. Située dans le sud de la France, à 74 km de Perpignan, la commune de Font-Romeu-Odeillo-Via bénéficie d’un ensoleillement exceptionnel. Elle est également célèbre pour la pureté de son air.
Les deux parties 1 et 2 sont indépendantes et peuvent être traitées dans l’ordre de votre choix.
Partie 1 : fonctionnement du four solaire
La lumière du Soleil est captée par 63 héliostats. De 45 m2 chacun, ils sont mobiles suivant deux axes pour suivre le mouvement apparent du Soleil tout en réfléchissant les rayons vers un grand miroir parabolique fixe, aussi appelé concentrateur. Les rayons réfléchis par les héliostats, parallèles à un axe Nord-Sud, éclairent toujours la même surface du concentrateur. Réfléchis une deuxième fois par la parabole du concentrateur, ils viennent enfin se concentrer dans un foyer situé 18 m en avant. La tache lumineuse fait seulement 40 cm de diamètre. Au niveau du foyer, la température peut atteindre 3400 °C.
D’après la vidéo : Odeillo, le Soleil apprivoisé, réalisée par le CNRS.
|
Compréhension générale du principe de fonctionnement
L’objectif est de retrouver, par calcul, la valeur de la puissance disponible au foyer du "Grand Four Solaire" d’Odeillo.
1.1. Exprimer, puis calculer, la puissance réfléchie par l’ensemble des héliostats.
1.2. Montrer que la valeur de la puissance au foyer du four d’Odeillo vaut 1,00·106 W.

Une expérience étonnante
Pendant la phase de mise au point du "Grand Four Solaire", des expériences ont été réalisées pour tester ses performances. Une plaque en acier de 10 mm d’épaisseur, positionnée au foyer et soumise au rayonnement solaire concentré, a ainsi été percée d’un trou de diamètre 40 cm égal à celui de la tache lumineuse en seulement 1 minute et 27 secondes.
La photo ci-contre représente une plaque en acier exposée à Odeillo à l'issue de l'expérience.
Données :
- L’acier est un mélange principalement composé de fer et de carbone. Ses caractéristiques varient donc en fonction de sa composition. Pour celui utilisé, on utilisera les valeurs moyennes suivantes :
- Température de fusion : 1500°C ;
- Température d’ébullition : 2800°C ;
- Masse volumique à l'état solide : 7200 kg·m-3;
- Capacité thermique massique à l'état solide : 460 J·kg-1·°C-1;
- Energie nécessaire à la fusion de 1 kg de cet acier : Lf = 2,50·105 J·kg-1.
- L’énergie E transmise lors de la fusion d’un échantillon de masse m à température constante est donnée par la relation : E = m Lf
- Le volume d’un cylindre de longueur e et de rayon R est : V = π R2 e
1.3. Indiquer, parmi les relations ci-dessous, celle liant la puissance et l’énergie.
| P = E Δt | P = E / Δt | P = Δt / E |
1.4. Quelle conversion d’énergie est réalisée au foyer du concentrateur afin que le rayonnement solaire concentré puisse percer une plaque en acier ?
1.5. En déduire la température minimale atteinte au foyer pendant cette expérience.
1.6. À l’aide du texte de fonctionnement du Grand Four Solaire et de la description de la plaque, montrer que la masse d’acier fondu est de l’ordre de 9 kg.
1.7. L’objectif est de retrouver, par calcul, la durée nécessaire au perçage de la plaque d’acier et de critiquer le modèle utilisé.
1.7.1. Estimer l’énergie nécessaire pour élever la température de l’acier jusqu’à sa température de fusion. On supposera que la température initiale de l’acier était celle de l’air ambiant, à savoir 20°C.
1.7.2. Estimer l’énergie nécessaire à la fusion de l’acier.
1.7.3. En déduire la durée nécessaire théorique pour réaliser cette expérience.
1.7.4. Comparer le résultat obtenu par calcul au résultat expérimental.
1.7.5. Expliquer la différence entre ces deux résultats en identifiant des transferts thermiques qui n’ont pas été pris en compte dans le modèle.
Partie 2 : la synthèse du dihydrogène par voie solaire
Le four solaire d'Odeillo permet d'envisager différents modes de synthèse du dihydrogène. L'objectif de cette partie est d'en étudier deux et de les comparer à la synthèse par vaporeformage du méthane.
La synthèse industrielle du dihydrogène par vaporeformage du méthane
Plus de 95 % de la production de dihydrogène se fait à partir de combustibles fossiles. Parmi les différents procédés, le vaporeformage est de loin le plus employé. Dans cette première partie, l’étude est centrée sur le vaporeformage du méthane.
Données : Masses molaires atomiques (en g.mol-1) : MH = 1,0 MC = 12,0 MO = 16,0.
Ce procédé de vaporeformage se déroule en 3 étapes.
1ère étape : la désulfuration
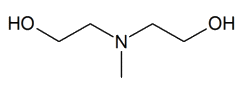
L’objectif de cette étape est d’extraire le sulfure d’hydrogène présent dans le gaz naturel. Cette extraction utilise de la méthyldiéthanolamine (MDEA) dont la formule topologique est donnée ci-contre. La MDEA et le sulfure d’hydrogène sont dissous en solution aqueuse et réagissent entre eux. L’équation de la réaction correspondante est la suivante :
H2S(aq) + MDEA(aq) → HS−(aq) + MDEAH+(aq)
2.1. Donner la formule brute de la MDEA.
2.2. Justifier que cette réaction est une réaction acide-base et donner les couples mis en jeu.
2.3. Le pH d’une solution aqueuse de MDEA de concentration molaire 0,10 mol·L-1 est égal à 10,7. Déterminer si la MDEA est un acide fort, une base forte, un acide faible ou une base faible.
2ème étape
Lors de cette deuxième étape réalisée à haute température (entre 850 et 900°C) et sous pression (20 à 30 bars), le méthane présent dans le gaz naturel désulfuré réagit avec l'eau en présence d’un catalyseur à base de nickel pour former du dihydrogène et du monoxyde de carbone.
2.4. Écrire l’équation de cette réaction.
3ème étape
Lors de cette dernière étape, on fait réagir le monoxyde de carbone obtenu précédemment avec de l’eau :
CO + H2O → CO2 + H2
2.5. Quel est l’intérêt de cette dernière étape ?
Le dihydrogène obtenu est ensuite séparé du dioxyde de carbone et purifié. Ce procédé présente un rendement élevé (de l’ordre de 80%). Il a un coût de production attractif (environ 2 euros le kg de dihydrogène) mais libère du dioxyde de carbone.
2.6. La synthèse du dihydrogène par vaporeformage peut être modélisée par une réaction qui correspond au bilan des réactions des deuxième et troisième étapes. Montrer que l’équation de cette réaction s’écrit :
CH4 + 2 H2O → CO2 + 4 H2.
En déduire la masse de dioxyde de carbone formé pour 1,0 kg de dihydrogène produit.
La synthèse du dihydrogène par voie solaire
Un des objectifs du four solaire d’Odeillo est de réussir à produire du dihydrogène sans émettre de gaz à effet de serre tel que le dioxyde de carbone. Il existe deux procédés de synthèse par voie solaire.
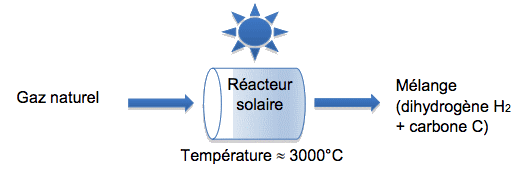
Procédé 1 : la décomposition directe du gaz naturel (CH4). Il faut ensuite séparer le dihydrogène des particules de carbone.
Procédé 2 : la décomposition de l’eau par cycles. Les chercheurs ont mis au point plusieurs cycles de réactions chimiques dont le bilan global permet la production de dihydrogène à partir d’eau. Deux cycles sont étudiés dans cette question.
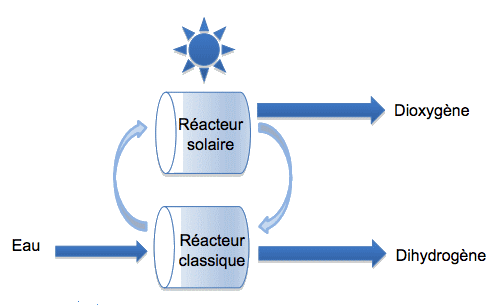
Cycle 1(mettant en œuvre du zinc)
Étape 1 réalisée dans le réacteur solaire à 1700 °C : ZnO → Zn + ½ O2
Étape 2 réalisée dans le réacteur classique à environ 800 °C : Zn + H2O → ZnO + H2
Cycle 2 (mettant en œuvre du fer)
Étape 1 réalisée dans le réacteur solaire à 1600 °C : Fe2O3 → 2 FeO + ½ O2
Étape 2 réalisée dans le réacteur classique à environ 600 °C : 2 FeO + H2O → Fe2O3 + H2
2.7. Écrire l’équation de la réaction qui correspond au bilan de la transformation mise en œuvre dans le cycle 1.
2.8. Quels sont les deux intérêts du procédé de décomposition par cycles de l’eau par rapport au procédé de la décomposition directe du gaz naturel ? Comparaison des deux voies de synthèse.
2.9. Dans le cadre de la chimie verte, trouver deux intérêts en faveur de la synthèse du dihydrogène par voie solaire par rapport à la synthèse industrielle du dihydrogène.
|