Carnet de bac
Annales
La vitamine C |
|
| Polynésie 2015 (remplacement) - Exercice 2 - 6 points |
|
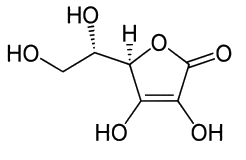
La vitamine C est une vitamine hydrosoluble, sensible à la chaleur et à la lumière. Elle joue un rôle important dans le métabolisme des êtres humains et de nombreux autres mammifères. Alors que la plupart des mammifères est capable de synthétiser la vitamine C, l’être humain en est incapable et il doit la puiser dans son alimentation. La vitamine C est principalement constituée d’acide L-ascorbique, un des stéréoisomères de l’acide ascorbique.
1. À propos de l’acide ascorbique La formule topologique de l’acide L-ascorbique est représentée ci-dessous.
1.1. Isomérie
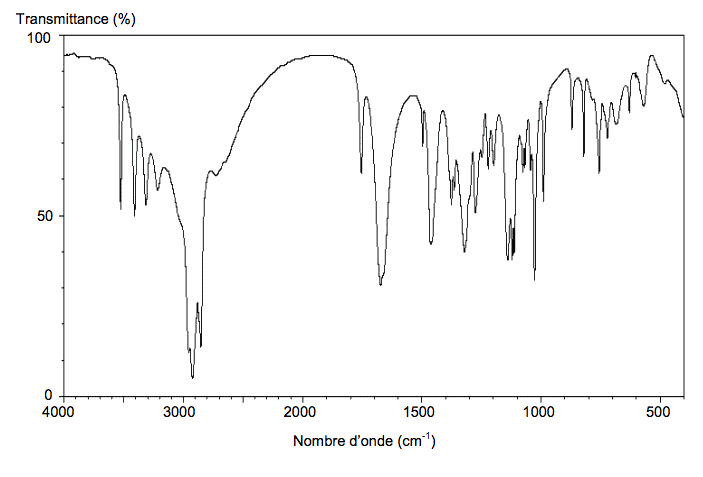
1.2.1. Vérifier que le domaine de longueurs d’onde de ce spectre se situe bien dans l’infrarouge.
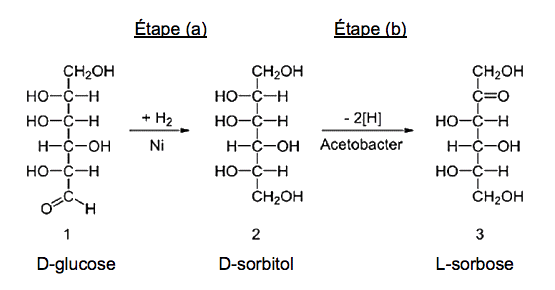
L’étape (a) est l’hydrogénation du D-glucose en D-sorbitol à l’aide d’un catalyseur : le nickel de Raney. L’étape (b) est l’oxydation par fermentation microbienne du D-sorbitol en L-sorbose. Des étapes ultérieures non détaillées ici permettent d’obtenir la vitamine C.
D’après Wikipédia
2.1. Étape (a)
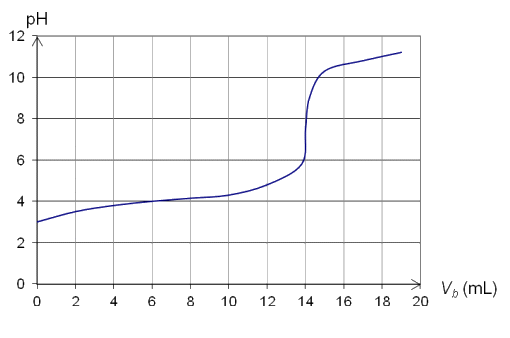
C6H8O6 (aq) + HO–(aq) → C6H7O6–(aq) + H2O(ℓ).
Huit titrages sont successivement réalisés dans un laboratoire d’analyse afin d’augmenter la précision du résultat. Un tableau regroupe les valeurs des différents volumes versés à l’équivalence :
3.1. Proposer une méthode permettant de repérer visuellement l’équivalence de ce titrage. Argumenter la réponse à l’aide des données et de vos connaissances.
|
|||||||||||||||||||||||||||||||||||||||||||||