|

Le miel est un mélange de composition complexe. Il est constitué principalement de sucres, dont le fructose et le glucose, d’eau, ainsi que d’autres substances, telles que des acides organiques, des enzymes et des particules solides provenant de sa récolte.
1. Le miel : un composé riche en sucres
Lorsque les abeilles ouvrières rapportent le nectar à la ruche, elles le transmettent à des receveuses par trophallaxie (bouche-à-bouche). Celles-ci le font alors transiter plusieurs fois entre leur bouche et leur jabot (petite poche servant de réservoir à nectar) puis le donnent à d’autres receveuses et ainsi de suite. Sous l’effet de l’invertase, une enzyme présente dans le jabot des abeilles, les sucres sont lentement modifiés : le saccharose est hydrolysé en fructose et glucose. Le nectar se transforme ainsi en miel.
D’après le site www.insectes.org
Données :
| Espèce chimique | Saccharose | D-glucose | D-fructose | Eau |
| Masse molaire | 342 g·mol-1 | 180 g·mol-1 | 180 g·mol-1 | 18 g·mol-1 |
| Représentation topologique | | 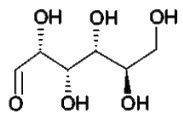 | 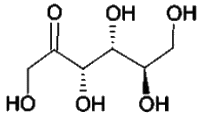 | |
Masse volumique de l’eau : ρ = 1,0 g·mL-1;
Solubilité du saccharose dans l’eau à 20° C : 2,0 kg·L-1 environ.
1.1. Molécules de glucose et de fructose.
1.1.1. Déterminer les formules brutes du D-glucose et du D-fructose.
1.1.2. Quels sont les points communs entre ces deux molécules ? Quelles sont les différences ? En déduire la relation qui les lie.
1.2. L’hydrolyse du saccharose
Sous l’effet de l’invertase, le saccharose de formule brute est C12H22O11 se transforme en glucose et en fructose dans le jabot des abeilles.
1.2.1. Modéliser, à l’aide des formules brutes, la transformation par une équation chimique. Vérifier qu’il s’agit bien d’une hydrolyse.
1.2.2. L’invertase est le catalyseur de la réaction d’hydrolyse du saccharose. Citer les différents types de catalyse. Quel type de catalyse est mis en œuvre pour cette hydrolyse dans le jabot des abeilles ?
1.2.3. Les abeilles n’hibernent pas, elles hivernent. Bien que leur activité soit ralentie, elles s’alimentent en consommant le miel stocké dans la ruche. Quand le stock est insuffisant, il faut les nourrir avec des sirops dont la composition est proche de celle d’un miel. Un apiculteur amateur prépare un « sirop léger » par dissolution de 0,50 kg de saccharose dans 1,0 L d’eau à 20 ° C et l’introduit dans une ruche. Déterminer la masse de glucose qui sera disponible pour les abeilles lorsqu’elles auront consommé le sirop, l’hydrolyse du saccharose étant considérée comme une réaction totale.
1.3. Le glucose est susceptible de fermenter : des microorganismes (levures) produisent une enzyme la zymase qui, par des réactions complexes, conduit le glucose à se décomposer. Cette décomposition est modélisée par l’équation suivante :
Glucose → 2 C2H6O + 2 CO2
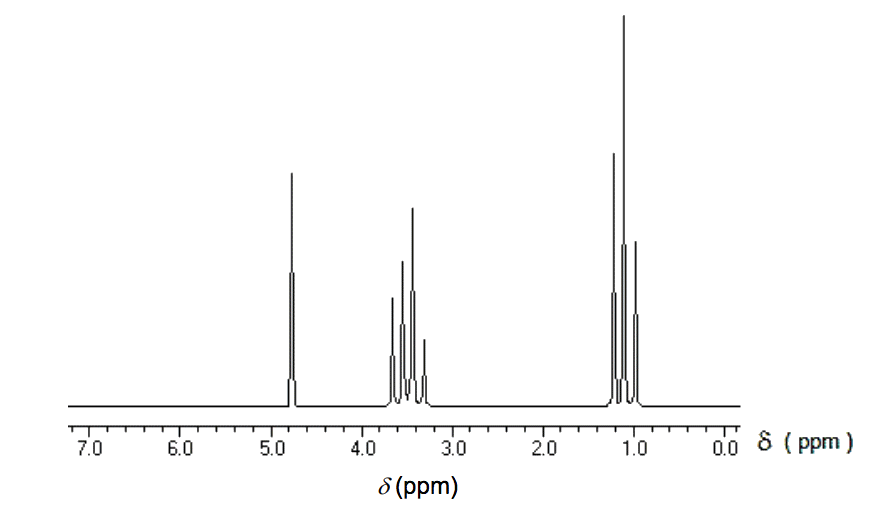
Le spectre RMN du proton, reproduit ci-dessous, est celui du produit C2H6O formé par fermentation. Donner la formule semi-développée de ce produit. Justifier votre démarche.
2. Les propriétés antiseptiques du miel
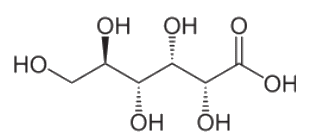
Acide gluconique
Plusieurs acides entrent dans la composition d’un miel. L’acide majoritaire dans le miel est l’acide gluconique, dont la formule est donnée ci-contre. Il provient de la transformation du glucose sous l’action d’une bactérie appelée gluconobacter.
La plupart des miels possèdent un pH compris entre 3,2 et 5,5. De nombreux microorganismes pathogènes (susceptibles de provoquer une maladie ou une infection) ne peuvent croître que si le pH est compris entre 7,2 et 7,4 ; le miel est donc un antiseptique et peut être utilisé pour soigner une plaie.
Donnée : Constante d’acidité du couple acide gluconique / ion gluconate en solution aqueuse à 25° C : pKa = 3,3.
2.1. Indiquer la catégorie de réaction correspondant à la transformation du glucose en acide gluconique.
2.2. Écrire la formule de l’ion gluconate en expliquant votre démarche, l’acide gluconique étant considéré comme un monoacide.
2.3. Quelle est l’espèce prédominante dans le miel lorsque le pH est compris entre 7,2 et 7,4 ? Justifier.
3. L’acidité libre d’un miel
Un pH trop faible révèle une dégradation biochimique suite à de mauvaises conditions de récolte ou de conservation. Parmi les paramètres spécifiques relatifs à la composition du miel, l’acidité libre constitue un critère important de qualité. La teneur en acidité libre dans un miel est donnée en milliéquivalents par kg (meq·kg-1). Elle correspond à la quantité d’ions hydroxyde en millimoles qu’il faudrait introduire pour amener 1 kg de miel à pH égal à 7. Les normes européennes tolèrent une acidité libre maximale de 40 meq·kg-1.
Protocole pour déterminer l’acidité libre du miel :
- Préparer une solution du miel à tester en dissolvant dans l’eau distillée 6,0 g de miel pour 50,0 mL de solution.
- Ajouter progressivement une solution d’hydroxyde de sodium de concentration Cb = 1,00·10-2 mol·L-1, en suivant l’évolution du pH.
- Tracer la courbe pH = f(Vb), Vb étant le volume de solution d’hydroxyde de sodium versé.
La courbe obtenue pour le titrage de l’acidité libre du miel analysé est représentée ci-dessous.
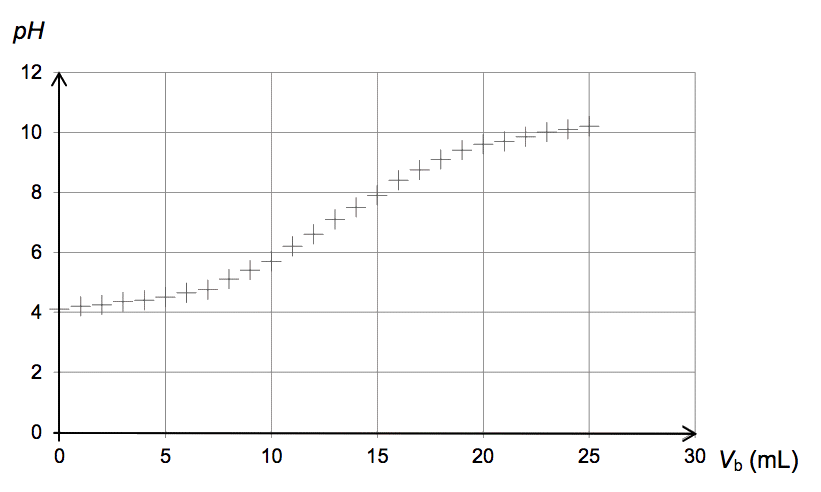
3.1. Rédiger le protocole de préparation des 50,0 mL de solution de miel en précisant la verrerie nécessaire.
3.2. Le miel testé respecte-t-il la réglementation européenne ?
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti. La démarche suivie est évaluée etnécessite d'être correctement présentée.
|







