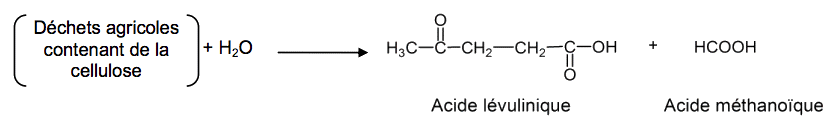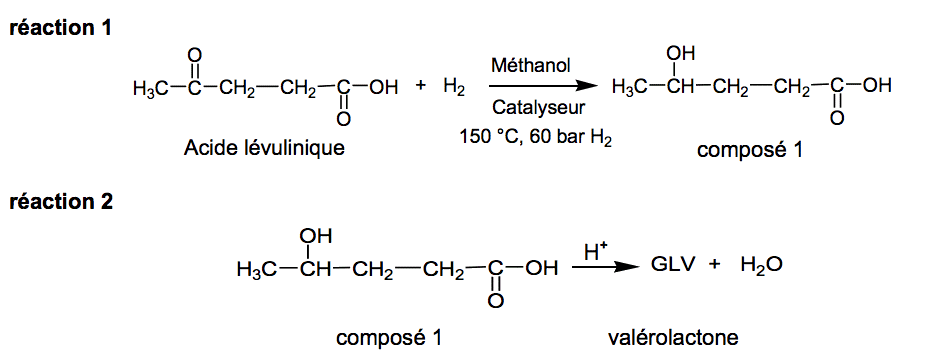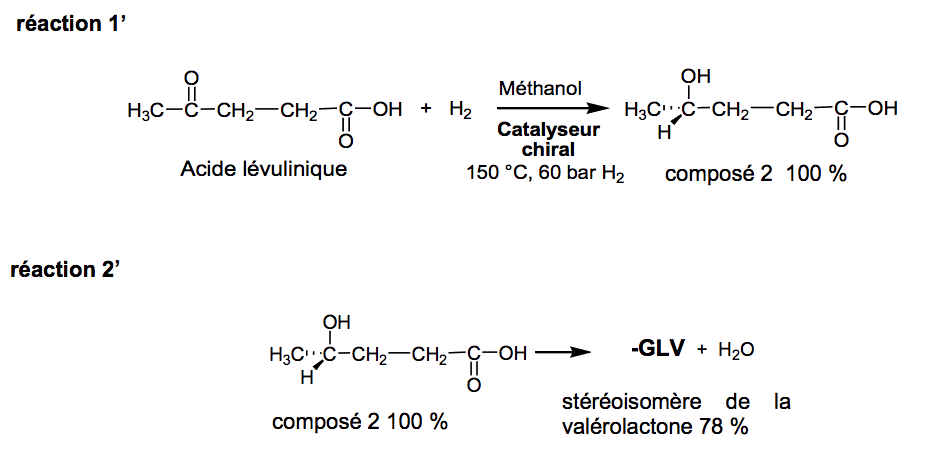Cet exercice porte sur l’optimisation de la synthèse de l’acide lévulinique et sur la transformation de l’acide lévulinique en valérolactone. L’acide lévulinique est synthétisé à partir de la cellulose présente dans les déchets agricoles. Il s’agit d’une molécule « plateforme » au sens où elle peut mener, par différentes transformations chimiques, à de nombreux produits d’intérêts tels que les composés pharmaceutiques, les plastiques, les parfums… Elle pourrait même remplacer à terme le pétrole comme matière première de l’industrie chimique.
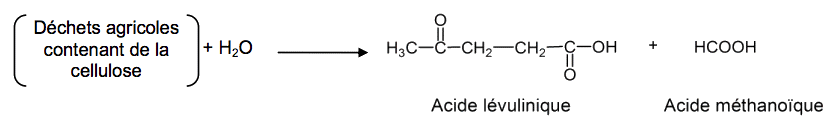
La cellulose est une macromolécule de formule brute (C6H10O5)n constituée d’une succession de n motifs.
Données :
|
Motif de la cellulose |
Acide lévulinique |
Acide méthanoïque |
Valérolactone |
Masse molaire M
(g·mol-1) |
162,1 |
116,1 |
46,0 |
100,1 |
Masse volumique
ρ (g·mL-1) |
1,50 |
1,14 |
1,22 |
1,05 |
Les 12 principes de la chimie verte :

D’après Cultures sciences
Table des nombres d’onde :
| Liaison |
Nombre d’onde (cm-1) |
Intensité F : fort ; m : moyen |
Famille |
| Ctet-H | 2850-3000 et 1430-1480 | F | Alcane |
| O-Hlié | 3200-3400 | F (large) | Alcool |
| O-Hlié | 2500-3200 | F à m (large) | Acide carboxylique |
| Ctri=O | 1700-1740 | F | Cétone |
| Ctri=O | 1700-1725 | F | Acide carboxylique |
| Ctri=O | 1735-1750 | F | Ester |
Ctet : carbone tétragonal (tétraédrique) Ctri : carbone trigonal
1. Optimisation du protocole de synthèse de l’acide lévulinique
Pour optimiser la synthèse de l’acide lévulinique, les chercheurs ont réalisé 6 synthèses en faisant varier différents paramètres.
Protocole général
Chaque synthèse a été réalisée sous agitation à 200 °C. Un volume d’eau V=4 mL contenant le catalyseur en quantité désirée a été mélangé à une masse m = 1,75 g de matière première (déchets agricoles) réduite en poudre sous atmosphère inerte de diazote. Les résultats des synthèses numérotées de 1 à 6 sont regroupés dans le tableau ci-dessous.
| Synthèse |
Matière première |
Teneur en cellulose (% massique) |
Irradiation microondes |
Durée de la synthèse (min) |
Catalyseur (quantité en mol pour 1 mole de cellulose) |
Rendement de la synthèse (%) |
| 1 | Branches d’olivier non productrices d’olives | 39,4 | Oui | 15 | 0,0115
Acide chlorhydrique | 51 |
| 2 | Sciure de peuplier | 57,6 | Non | 60 | 0,0115
Acide chlorhydrique | 37 |
| 3 | Sciure de peuplier | 57,6 | Oui | 15 | 0,0115
Acide chlorhydrique | 45,8 |
| 4 | Boues de papier | 57,1 | Non | 60 | 0,0115
Acide chlorhydrique | 55,1 |
| 5 | Boues de papier | 57,1 | Oui | 15 | 0,0115
Acide chlorhydrique | 55,5 |
| 6 | Boues de papier | 57,1 | Non | 60 | 0,0115
Acide sulfurique | 26,5 |
D’après Gale i e al. (2012). Levulinic Acid from waste, BioResources.
1.1. Citer les paramètres que les chercheurs ont fait varier pour optimiser cette synthèse.
1.2. Identifier le paramètre favorisant le rendement de la synthèse qui est mis en évidence dans les synthèses 2 et 3. Justifier.
1.3. Identifier le paramètre ayant une influence sur le rendement de la synthèse qui est mis en évidence par les synthèses 2 et 4. Préciser son influence.
1.4. Quel catalyseur est-il préférable de choisir ? Justifier.
1.5. Quelle expérience, parmi celles proposées, correspond à la s nthèse de l’acide lévulinique la plus « verte » possible ? Justifier.
1.6. Si le rendement était de 100%, on obtiendrait une mole d’acide lévulinique pour une mole d’un motif de cellulose transformée. Déterminer la masse expérimentale mexp réellement obtenue en acide lévulinique dans l’expérience 5.
2. Transformation de l’acide lévulinique en valérolactone
La valérolactone est un précurseur de nombreux composés pharmaceutiques permettant de lutter, par exemple, contre l’hypertension ou la leucémie. L’objectif de cette partie est d’étudier deux voies de synthèse de la valérolactone.
2.1. Étude théorique d’une première voie de synthèse de la valérolactone
La valérolactone peut être synthétisée directement à partir de l’acide lévulinique par deux réactions successives 1 et 2 dont les équations sont données ci-après :
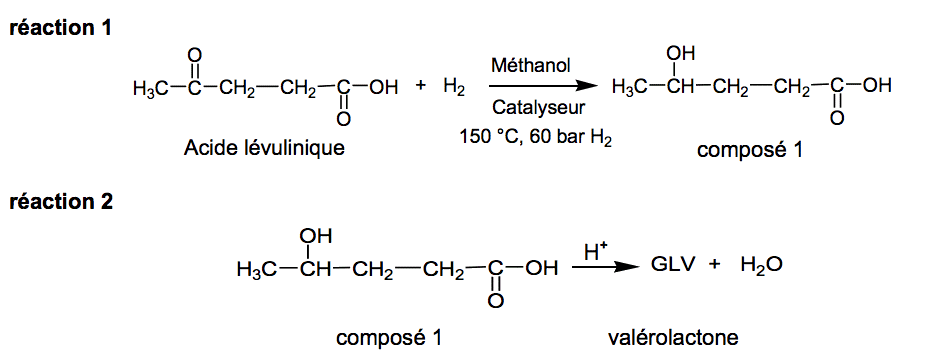
2.1.1. Recopier l’équation de la réaction en utilisant les formules topologiques. Entourer les groupes caractéristiques et nommer les fonctions correspondantes.
2.1.2. À quelle catégorie de réaction, la réaction 1 appartient-elle ?
2.1.3. Recopier la formule semi-développée de l’acide lévulinique sur votre copie, entourer les groupes de protons équivalents et prédire la multiplicité du signal en RMN du proton pour chaque groupe de protons.
2.1.4. Expliquer comment les chercheurs peuvent s’assurer de l’existence du composé 1, à la fin de la réaction 1, par spectroscopie infrarouge (IR) et par résonance magnétique nucléaire du proton (RMN).
2.1.5. Au cours de la réaction 1, deux stéréoisomères du composé 1 sont obtenus. Donner les représentations de Cram de ces deux stéréoisomères. Par quelle relation de stéréoisomérie sont-ils liés ? Justifier.
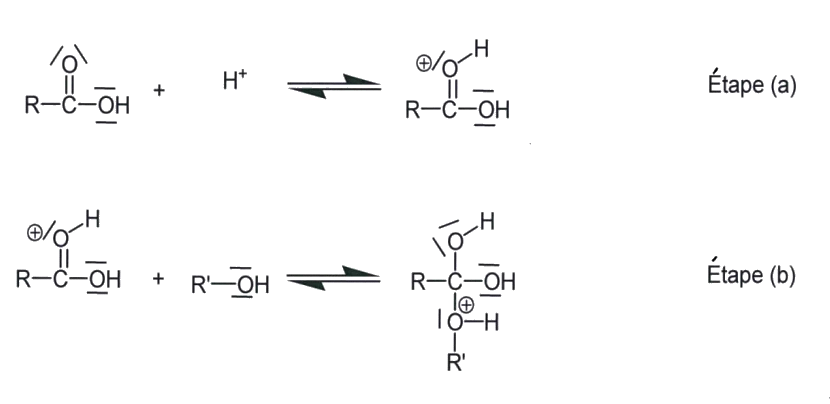
2.1.6. La réaction 2 est une estérification particulière : la molécule du composé 1 possède les deux fonctions qui peuvent réagir entre elles pour donner un ester cyclique, la valérolactone. Sur une partie du mécanisme simplifié d’estérification intramoléculaire donné en annexe à rendre avec la copie, compléter les étapes a et b à l'aide du formalisme des flèches courbes.
2.2. Étude de la deuxième voie de synthèse sélective d’un stéréoisomère de la valérolactone
Dans une publication de juillet 2015, des chercheurs expliquent comment ils sont parvenus à synthétiser de manière préférentielle l’un des stéréoisomères de la valérolactone à l’aide d’un catalyseur chiral. Deux réactions chimiques successives mènent à ce stéréoisomère.
Protocole de la synthèse sélective du stéréoisomère de la valérolactone
Un volume V =75 mL d’une solution méthanolique d’acide lévulinique à la concentration massique Cm=785 g·L-1 est placé sous une atmosphère chargée en dihydrogène (H2) à la pression P = 60 bar et chauffé à une température de 150 °C en présence de 0,009 mmol du catalyseur chiral sous agitation pendant 20 h. Après traitement du milieu réactionnel et purification, un volume V’ = 0,38 mL du stéréoisomère de la valérolactone est obtenu sous la forme d’un liquide incolore. Les équations des deux réactions sont données par :
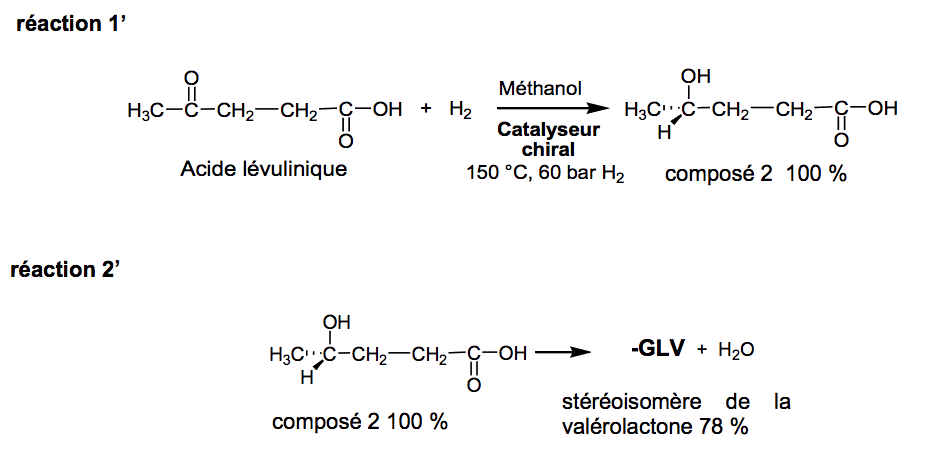
D’après József M. Tukacs e al. 2015. Direct asymmetric reduction of levulinic acid to γ-valerolactone : synthesis of a chiral platform molecule, Green Chem.
2.2.1. Justifier la nécessité de trouver des synthèses ne menant qu’à un seul stéréotiomère dans l’industrie pharmaceutique.
2.2.2. Quelle est la quantité initiale nacide d’acide lévulinique transformée lors de cette synthèse ?
2.2.3. Calculer le volume maximal théorique Vmax de valérolactone susceptible d’être obtenu lors de cette synthèse si le rendement des deux réactions était de 100 % et le dihydrogène H2 introduit en excès. Le volume V’ réellement obtenu du stéréoisomère de la valérolactone est-il compatible avec le rendement de 78% de la réaction 2’ indiqué dans la publication ?
|