Carnet de bac
Annales
Éliminer le tartre |
|
| Métropole 2017 - Exercice 3 -5 points |
|
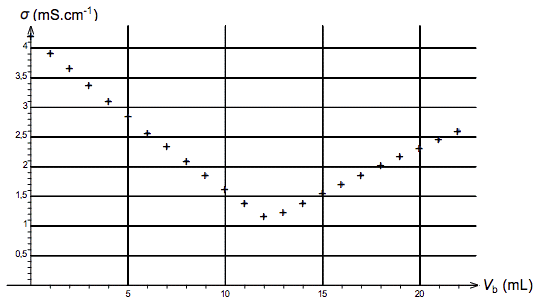
Dans nos maisons, les dépôts de tartre sont nombreux. Ils se forment sur les robinets, dans les baignoires, les lavabos, les éviers, les lave-linge… Ces dépôts de tartre sont constitués de carbonate de calcium, de formule CaCO3(s). Ils peuvent être dissous en utilisant des solutions acides telles que les solutions de détartrants commerciaux.
H3O+(aq) + HO-(aq) → 2 H2O(ℓ)
2 H3O+(aq) + CaCO3 (s) → Ca2+(aq) + CO2(g) + 3 H2O(ℓ)
On souhaite détartrer la surface extérieure du tambour cylindrique fermé d’un lave-linge recouvert d’une épaisseur de calcaire d’environ 10 µm. Le schéma légendé du tambour est fourni figure 2. Étant donnée la faible épaisseur de la couche de tartre, son volume est approximativement égal au produit de la surface extérieure du tambour par l’épaisseur de la couche de tartre.
|