|

L’acide butanoïque est l’un des composés responsables de l’odeur très forte et du goût piquant de certains fromages et beurres rances. Cet exercice se propose d’étudier quelques propriétés de l’acide butanoïque, sa formation dans les fromages et son titrage dans le beurre.
Données :
- l’acide butanoïque C4H8O2 est un acide faible ; le pKa du couple acide / base auquel il appartient vaut 4,8 à 25 °C
- masse molaire de l’acide lactique : M1 = 90,0 g·mol-1
- masse molaire de l’acide butanoïque : M2 = 88,0 g·mol-1
1. Quelques propriétés de l’acide butanoïque
1.1. Représenter la formule topologique de l’acide butanoïque.
1.2. Écrire l’équation de la réaction entre l’acide butanoïque et l’eau.
1.3. À 25 °C, le pH d’une solution aqueuse d’acide butanoïque de concentration 3,0·10-2 mol·L-1 vaut 3,2. Cette valeur de pH est-elle en accord avec le caractère « acide faible » attribué à l’acide butanoïque ?
1.4. Quelle espèce chimique du couple acide / base de l’acide butanoïque est prédominante dans la solution précédente ? Justifier.
2. La fermentation butyrique dans le fromage
Dans les fromages, l’acide butanoïque est produit par fermentation de l’acide lactique du lait en présence de la bactérie Clostridium tyrobutyricum. Cette fermentation, dite butyrique, est modélisée par la réaction totale d’équation :
2 C3H6O3 (aq)
acide lactique |
→ |
C4H8O2 (aq) + 2 CO2 (g) + 2 H2 (g)
acide butanoïque |
Les premiers signes de fermentation butyrique sont généralement visibles après 6 à 10 semaines d’affinage. Cela se manifeste par un goût rance et, très souvent par un gonflement, voire un éclatement des fromages. Le phénomène peut conduire à la destruction de toute une production.
D’après Agroscope
2.1. Justifier le gonflement des fromages lors de la fermentation butyrique.
2.2. Le site www.agroscope.com indique par ailleurs que la fermentation de 2,0 g d’acide lactique conduit à la formation d’environ 1 g d’acide butanoïque. Vérifier que cette information est correcte.
3. Analyse d’un beurre
Un beurre est rance si le pourcentage en masse d’acide butanoïque qu’il contient est supérieur ou égal à 4 %, c’est-à-dire qu’il y a plus de 4 g d’acide butanoïque dans 100 g de beurre. On peut titrer l’acide butanoïque contenu dans un beurre de la façon suivante. Dans un bécher, on introduit 8,0 g de beurre fondu auquel on ajoute un grand volume d’eau distillée. On agite afin de dissoudre dans l’eau la totalité de l’acide butanoïque présent dans le beurre.
Dans le bécher, on plonge la sonde d’un conductimètre, puis on verse, mL par mL, une solution d’hydroxyde de sodium (Na+(aq) + HO-(aq)) de concentration C = 4,0·10-1 mol·L-1. Après chaque ajout de solution titrante, on mesure la conductivité σ de la solution dans le bécher. On considère que seul l’acide butanoïque réagit avec le réactif titrant. L’équation de la réaction support du titrage est la suivante :
C4H82 (aq) + HO-(aq) → H2O (ℓ) + C4H7O2- (aq)
La courbe représentant les variations de la conductivité σ en fonction du volume Vb de solution d’hydroxyde de sodium versé est représentée sur la figure 1.
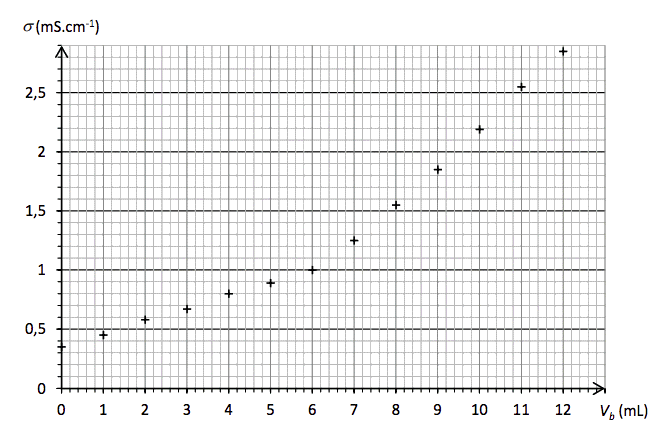
Figure 1. Titrage de l’acide butanoïque contenu dans 8,0 g de beurre par une solution d’hydroxyde de sodium de concentration molaire égale à 4,0·10-1 mol·L-1.
3. Le beurre analysé est-il rance ?
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti. La démarche suivie est évaluée et nécessite donc d'être correctement présentée.
|