Carnet de bac
Annales
Le manioc |
➔ |
| Liban 2018 - Exercice 2 - 4 points |
|
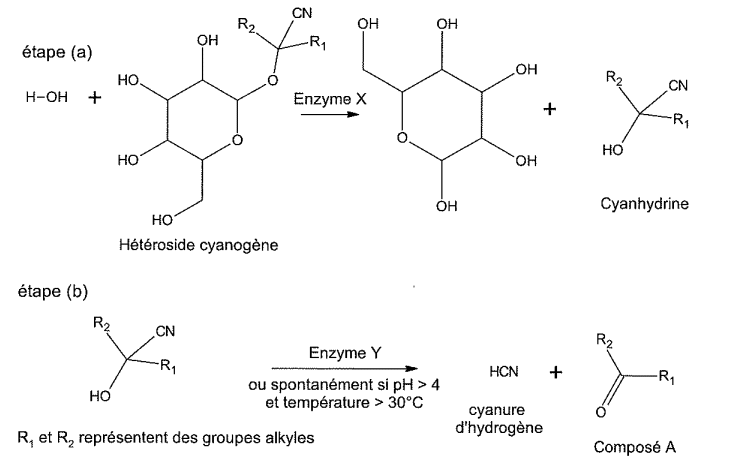
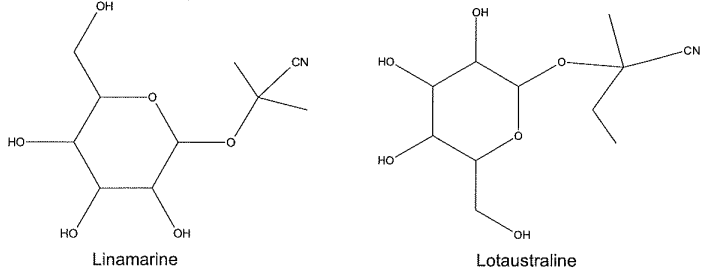
Le manioc est un arbuste qui constitue une source importante de l'alimentation des régions tropicales ou subtropicales. On consomme les racines (ou tubercules) et aussi parfois les feuilles. La consommation de manioc nécessite une préparation soigneuse afin de lui enlever son caractère potentiellement dangereux. En effet, le manioc contient des hétérosides cyanogènes à l'intérieur des cellules de tous ses tissus. L'altération des parois cellulaires de la plante par découpage, broyage, râpage ou macération conduit à la mise en contact des hétérosides cyanogènes avec des enzymes, ce qui provoque une réaction d'hydrolyse qui génère entre autre du cyanure d'hydrogène HCN.
I2 (aq) + 2 S2O32-(aq) → 2 I-(aq) + S4O62-(aq)
|