Carnet de bac
Annales
Synthèse de l’acétate d’éthyle |
➔ |
| Pondichéry 2014 - Exercice 2 - 5 points |
|
L'acétate d'éthyle est un liquide utilisé comme solvant pour les vernis à ongles et certaines colles, en raison de sa faible nocivité et de sa volatilité importante. Il est aussi utilisé dans l’industrie agroalimentaire dans certains arômes fruités.
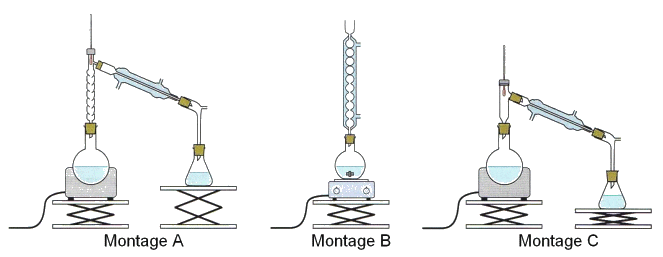
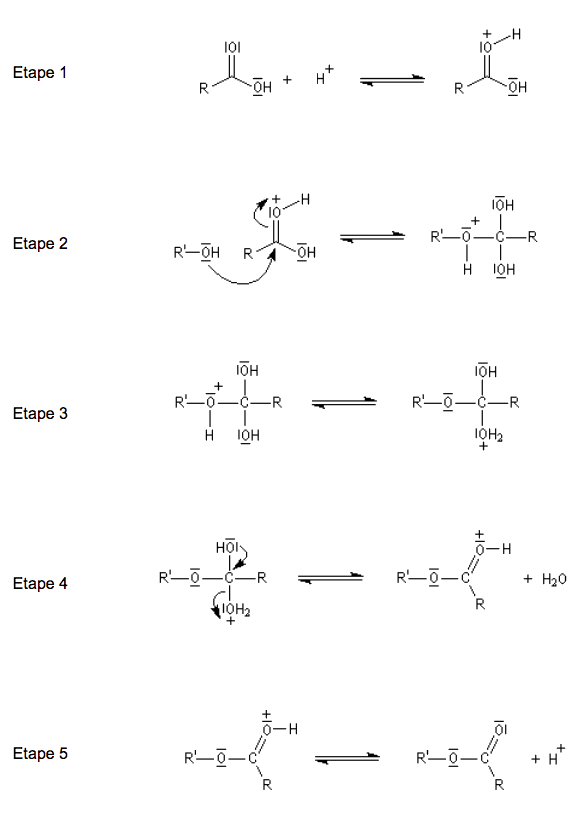
1. Réaction de synthèse
CH3COOH(ℓ) + C2H5OH(ℓ) ⇌ CH3COOC2H5(ℓ) + H2O(ℓ)
1.1. Identifier, en justifiant votre réponse, les fonctions chimiques des molécules organiques intervenant dans la réaction de synthèse.
|
| Annexe | |
|
| |