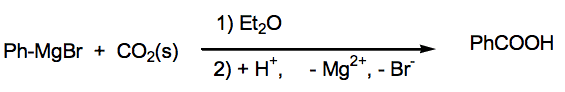Carnet de bac
Annales
Le dioxyde de carbone : le réduire dans l'atmosphère et le valoriser |
|
| Antilles 2014 (remplacement) - Exercice 3 - 5 points |
|
1. Traitement des eaux usées alcalines par le dioxyde de carbone | ||
|
Document 1
Pour pouvoir déverser des eaux usées dans les canalisations ou dans les eaux du domaine public, il faut que celles-ci aient un pH généralement compris entre 6,5 et 8,5. Les eaux usées alcalines (basiques) peuvent être « neutralisées » avec des acides minéraux ; cependant, le procédé technique est complexe et l’utilisation de ces acides n'est pas sans problème : corrosion, salinisation (chlorures, sulfates, phosphates, nitrates), risque de surdosage. La « neutralisation » au dioxyde de carbone s'impose dans la plupart des cas comme la solution la plus efficace. Les domaines industriels concernés sont multiples : blanchisseries, industries du papier et de la cellulose, industries textiles, laiteries… D’après Linde-gas |
||
|
Données : couples acide / base
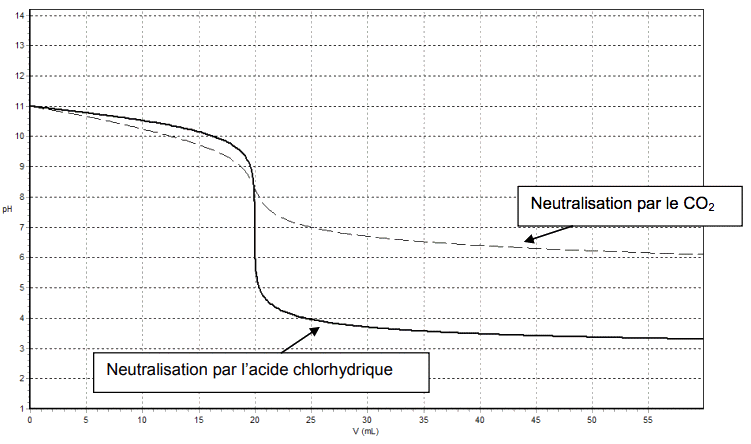
Un groupe d’élèves a comparé la « neutralisation » des eaux alcalines par un acide minéral et par le dioxyde de carbone à l’aide d’un logiciel de simulation. Dans cette simulation, les eaux usées alcalines sont modélisées par une solution aqueuse d’hydroxyde de sodium (Na+(aq) + HO-(aq)) notée S, de concentration molaire apportée c = 1,0·10-3 mol·L-1. Le document 2 montre l’évolution du pH de la solution S lorsqu’on ajoute une solution acide. Les solutions acides utilisées sont d’une part, une solution d’acide chlorhydrique (H3O+(aq) + Cl(aq)), d’autre part une solution aqueuse de dioxyde de carbone (H2O, CO2(aq)), de mêmes concentrations molaires apportées cA = 1,0·10-3 mol·L-1. |
||
|
Document 2
|
||
1.1. Écrire l’équation de la réaction qui se produit lors de l’ajout de l’acide chlorhydrique dans la solution S.
|
||
|
Document 3
D’après l’Agence De l’Environnement et de la Maîtrise de l’Énergie |
||
|
Document 4
Le dioxyde de carbone sert également en synthèse organique en tant que réactif et peut donc être valorisé par transformation chimique.
Synthèse industrielle : synthèse de l’urée CO(NH2)2 (70 millions de tonnes par an) L'urée est fabriquée industriellement à partir d'ammoniac (NH3) et de dioxyde de carbone (CO2). La réaction de synthèse se fait sous forte pression (de 140 à 160 bar) et à des températures comprises entre 160 °C et 180 °C. Elle a lieu en deux temps : 1. Synthèse du carbamate d'ammonium (NH2COONH4), produit intermédiaire stable uniquement sous haute pression : CO2 + 2 NH3 → NH2COONH4 2. Décomposition du carbamate d'ammonium en urée et eau : NH2COONH4 → CO(NH2)2 + H2O. |
||
|
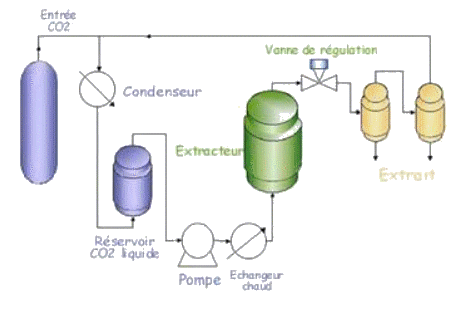
Document 5
Le dioxyde de carbone peut directement être utilisé dans les procédés d’extraction supercritique. L’extraction par le CO2 supercritique permet d'obtenir des parfums, fragrances et ingrédients actifs à partir d'un solvant d'origine naturelle : le dioxyde de carbone CO2. Le procédé d'extraction au CO2 supercritique permet d'obtenir des extraits sous leur forme la plus naturelle qui soit car seul le CO2 est mis en contact sous haute pression avec le végétal, le tout à faible température, garantissant ainsi la préservation de toutes les substances actives.
Le procédé d’extraction se décompose selon les étapes suivantes :
D’après Aroma-zone |
||
|
Document 6
Les microalgues sont des plantes microscopiques présentes dans les rivières, les lacs et les océans. Pour leur croissance, elles ont besoin de soleil, d’eau et de dioxyde de carbone. On injecte le CO2 capté dans des bassins de microalgues, puis la biomasse ainsi
produite sera transformée en biocarburant (application qui présente le plus grand enjeu), servira au traitement de l’eau ou à la production de molécules à haute valeur ajoutée pour l’alimentation et la santé.
|
||
|
Document 7
La biocatalyse vise à reproduire des phénomènes naturels en utilisant des enzymes pour catalyser une réaction chimique et ainsi convertir le dioxyde de carbone en molécules (lipides et composés oxygénés) intéressantes pour l’industrie pharmaceutique, la production d’hydrogène et, ultérieurement, la production de biocarburants. La biocatalyse est au stade de la recherche. |
||