Carnet de bac
Annales
Du lait au yaourt |
➔ |
| Liban 2014 - Exercice 1 - 6 points |
Le lait est un produit biologique fragile. L’homme a su exploiter la tendance qu’ont ses composants à se séparer afin de le conserver. Pour faire du beurre, on recueille la matière grasse mais pour obtenir du fromage ou du yaourt, on attend que les protéines du lait coagulent. L’acide lactique est l’un des composants essentiels du lait.
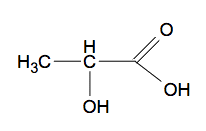
1. L’acide lactique
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Document 1 : Acidité du lait
Un lait frais n’est que très légèrement acide mais cette acidité peut se développer assez vite pour des raisons diverses :
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Document 2 : Protocole de titrage d’un lait
On verse 10,0 mL de lait dans un erlenmeyer et on ajoute quelques gouttes de phénolphtaléine. On procède au titrage de l’échantillon de lait par une solution d’hydroxyde de sodium (Na+(aq) + HO–(aq)) de concentration molaire 0,11 mol·L-1 appelée soude « Dornic ». |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Un lait est dosé en suivant ce protocole. L’équation de la réaction chimique support de titrage est :
H+(aq) + HO–(aq) → 2 H2O(ℓ)
2.1. La persistance d’une coloration rose est observée pour un volume de solution titrante versée de 1,4 mL. À quoi correspond ce changement de couleur ?
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Document 3 : Fabrication d'un yaourt
Le lait pasteurisé est ensemencé avec des bactéries (lactobacillus bulgaricus et streptococcus thermophilus) et mis en pots. Ces bactéries vont alors se multiplier et transformer le lactose du lait en acide lactique. La consistance du yaourt est atteinte au bout de quelques heures. Les yaourts sont ensuite refroidis à 4°C ; le froid bloque l’activité des bactéries mais ne les tue pas : au moment de la vente, le yaourt doit contenir au moins 10 millions de bactéries par gramme !
D’après les sites www.espace-sciences.org et www.decouverte-industries-alimentaires.com |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Document 4 : Acidité et température
Afin d’optimiser la fabrication d’un yaourt dans un atelier de production, un laboratoire de recherche mesure, à différentes températures, l’évolution dans le temps de l’acidité de différents échantillons d’un lait préalablement ensemencé avec des bactéries. Les valeurs obtenues sont reportées dans les tableaux ci-dessous. Pour une température θ1= 2°C
Pour une température θ2= 25°C
Pour une température θ3= 45°C
Pour une température θ4= 80°C
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Document 5 : Précipitation de la caséine
Le point isoélectrique d’une protéine est la valeur du pH pour lequel la somme des charges électriques présentes sur les différents groupes caractéristiques de la protéine s’annule. La protéine est alors dénaturée.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Document 6 : Evolution du pH lors de la fabrication du yaourt dans un atelier de production industrielle
Le graphe suivant donne l'évolution au cours du temps du pH d'un lait ensemencé.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||