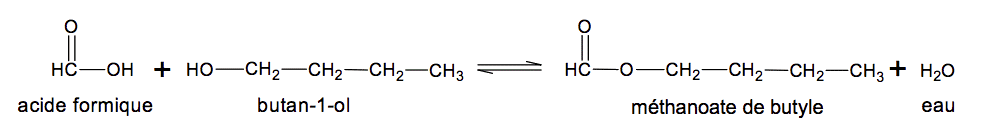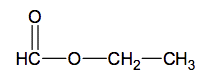Carnet de bac
Annales
D'une odeur âcre à une odeur fruitée |
|
| Métropole 2014 - Exercice 2 - 9 points |
|
Les esters ont souvent une odeur agréable. On les trouve naturellement dans les fruits dont ils sont souvent responsables de l’arôme. La parfumerie et l’industrie alimentaire utilisent aussi les esters et les obtiennent par extraction ou par synthèse.
|
||||||||||||||||||
|
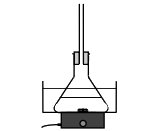
Protocole
Préparer un bain-marie à une température d’environ 50 °C. Sous la hotte, verser dans un erlenmeyer 7,5 mL d’acide formique, puis 18,0 mL de butan-1-ol, ajouter 3 gouttes d’acide sulfurique concentré. Surmonter l’erlenmeyer contenant le mélange d’un réfrigérant à air, le placer dans le bain-marie et assurer une agitation douce. |
||||||||||||||||||
|
L’équation de la réaction de synthèse est :
On se propose d’étudier les caractéristiques de la synthèse du méthanoate de butyle à partir de l’acide formique puis d’identifier des esters. Le candidat utilisera ses connaissances ainsi que les informations fournies.
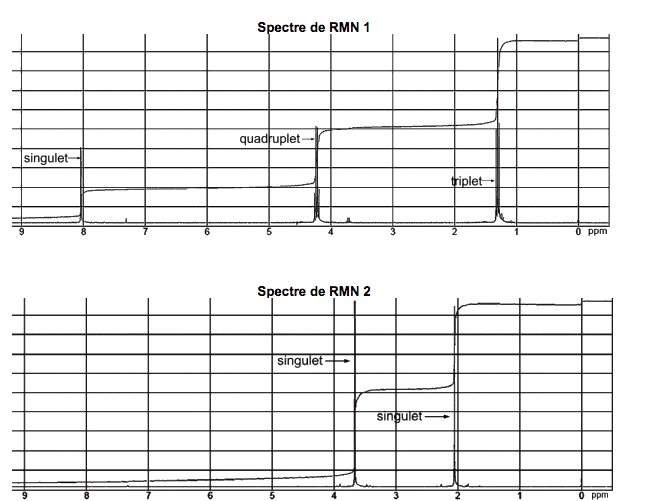
La distinction des esters par l’odeur peut être incertaine, en particulier dans le cas du méthanoate d’éthyle et de l’éthanoate de méthyle. La formule semi-développée du méthanoate d’éthyle est :
| ||||||||||||||||||
|
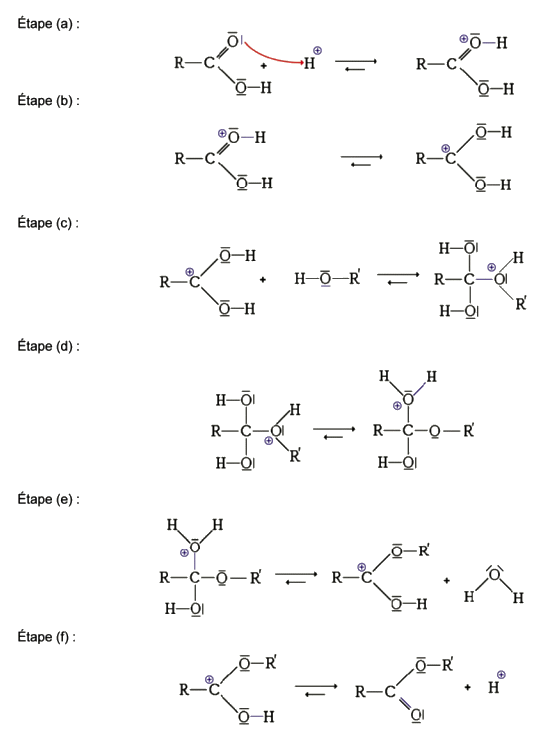
Document 1. Mécanisme réactionnel de la synthèse du méthanoate de butyle
|
||||||||||||||||||
|
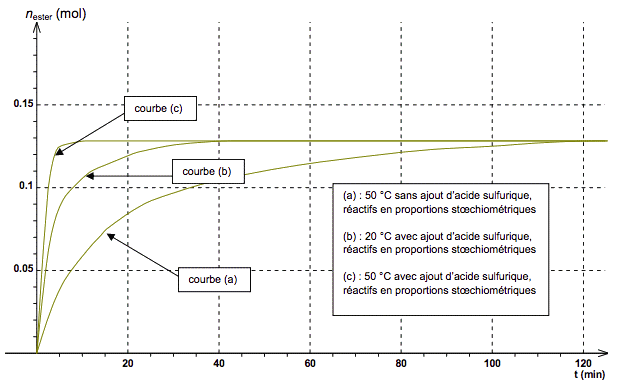
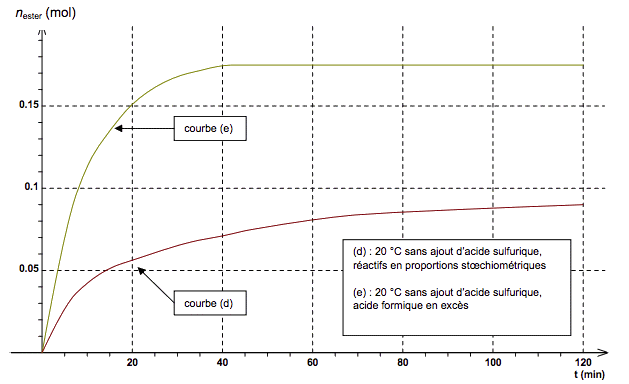
Document 2. Etude expérimentale de la synthèse du méthanoate de butyle
Pour optimiser cette synthèse, des études expérimentales sont menées dans différentes conditions. La quantité initiale de butan-1-ol utilisée est celle du protocole. Les résultats sont représentés par les graphiques ci-dessous.
Document 2.b.
|
||||||||||||||||||
|
Document 3. Spectres de RMN du proton de l’éthanoate de méthyle et du méthanoate d’éthyle
|
||||||||||||||||||