Carnet de bac
Annales
Autour de l'odeur de rhum |
|
| Métropole 2014 (remplacement) - Exercice 3 - 5 points |
|
Le rhum est une boisson alcoolisée utilisée dans la conception de pâtisseries ou de cocktails et fabriquée à partir de canne à sucre. Ses particularités gustatives sont diverses et dépendent des variétés et du lieu de culture de la matière première employée.
|
||||||||||||||||||||
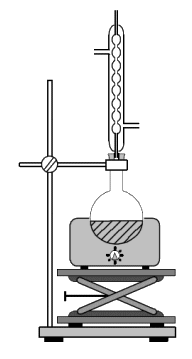
Document 1. Synthèse d’un ester par la réaction dite de Fischer
|
||||||||||||||||||||
Document 2. Données physico-chimiques
|
||||||||||||||||||||
|
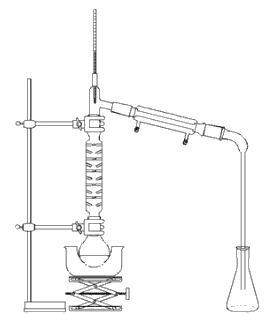
Document 3. Synthèse du méthanoate d’éthyle par différentes méthodes
Protocole 1 :
Protocole 4 :
|
||||||||||||||||||||