Carnet de bac
Annales
Une voie de valorisation possible pour le dioxyde de carbone |
➔ |
| Nouvelle-Calédonie 2013 - Exercice 3 - 5 points |
|
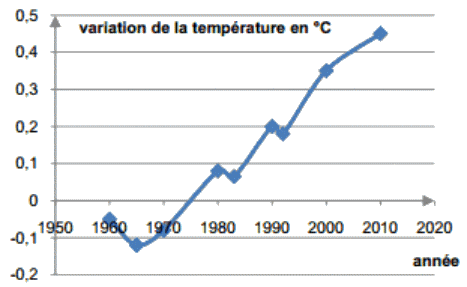
Diminuer les émissions de gaz carbonique constitue l’un des défis majeurs du XXIe siècle. Si aujourd’hui, une faible quantité (0,5%) des émissions de CO2 issues des activités humaines est valorisée au niveau mondial, certains experts estiment que la valorisation du CO2 pourrait à terme absorber annuellement jusqu’à 5 à 10% des émissions mondiales.
| ||||
Document 1 – Données du GIEC (groupe intergouvernemental d’expert sur l’évolution du climat)
| ||||
|
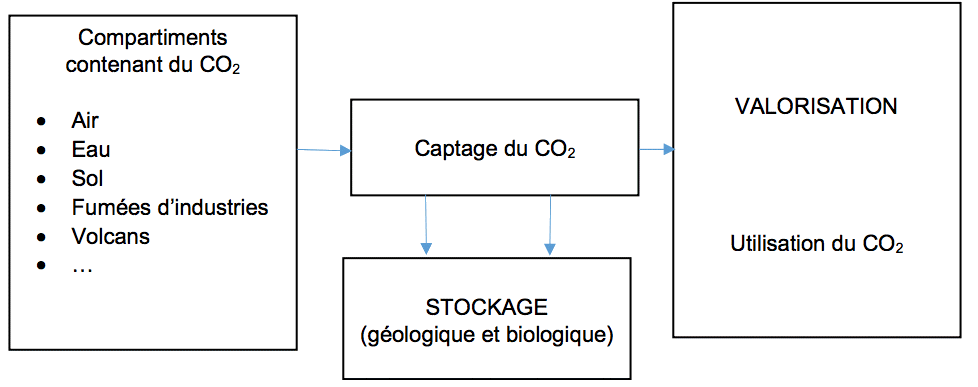
Document 2 – Traitement du dioxyde de carbone
Source : Greenhouse gas carbon dioxide mitigation, Halmann, Steinberg, 1997 | ||||
|
Document 3 – L’hydrogénation, une voie de valorisation du dioxyde de carbone
Actuellement, le CO2 est valorisé soit de manière directe, par exemple en étant utilisé comme gaz réfrigérant, soit de manière indirecte. Le CO2 est alors converti en un autre produit d’intérêt industriel. L’hydrogénation du CO2 (réaction avec le dihydrogène et production d’eau dite réaction de Sabatier) est la voie de conversion la plus étudiée. Elle peut conduire directement à la formation d’alcools, d’hydrocarbures… C’est ainsi que les synthèses du méthanol et de l’éthanal CH3-CHO sont souvent envisagées, de même que la réaction qui mène au méthane. Cette dernière implique toutefois une plus large consommation de dihydrogène. | ||||
|
Document 4 – Unité de production de méthane au Japon
L’un des grands groupes pétroliers – BP – et l’université technologique de Tohoku développent, depuis 2003, une unité pilote de production de méthane à partir de CO2 industriel et de dihydrogène produit par électrolyse de l’eau de mer. Cette électrolyse est alimentée par de l’énergie solaire.
L’unité consomme 4 m3/h de dihydrogène et 1 m3 /h de CO2 pour produire 1 m3/h de méthane. À l’heure actuelle, le méthane produit n’est pas utilisé industriellement mais pourrait être utilisé comme combustible pour produire de l’électricité ou comme carburant pour des véhicules. La production d’électricité avec ce méthane serait préférable, elle permettrait le recyclage des émissions de CO2 ; alors que l’utilisation du méthane comme carburant pour véhicule n’autoriserait pas ce recyclage car les émissions de CO2 sont diffuses.
D’après le rapport de l’ADEME – Panorama sur la valorisation du CO2 , juin 2010. Données énergétiques Énergie nécessaire pour : • réaliser l’électrolyse de l’eau afin de fabriquer 1,0 m3 de dihydrogène : 20,0 MJ ; • capturer et stocker 1,0 m3 de dioxyde de carbone industriel : 8,0 MJ • réaliser l’hydrogénation de 1,0 m3 de CO2 selon la réaction de Sabatier : 7,0 MJ • énergie récupérable par la combustion de 1,0 L de méthane : 33,0 kJ | ||||
|
Synthèse de documents
Questions préalables
|
||||