Carnet de bac
Annales
L'acidification des océans |
➔ |
| Nouvelle-Calédonie 2013 - Exercice 2 - 9 points |
|
Moules et huîtres menacées par l’acidification des océans
D’après CNRS et acidification des océans
Le début de l'année 2009 a marqué le début d'une nouvelle ère dans l'étude du changement climatique, avec le lancement par les japonais du premier satellite du monde consacré à l'observation des gaz de l'atmosphère terrestre qui contribuent au réchauffement climatique. Le satellite appelé IBUKI, ce qui signifie «souffle» en japonais, est équipé de capteurs de haute précision qui peuvent sonder environ 56 000 points sur la planète. L'agence spatiale japonaise a décidé de diffuser gratuitement les données du satellite aux scientifiques du monde entier. Elles seront utilisées notamment pour étudier des modèles de cycle du carbone actuellement utilisés pour tenter non seulement de reconstituer les flux entre les différents réservoirs (sols, air, eau, biosphère) mais aussi pour tenter de reconstituer les flux d'émissions anthropiques. D’après Sciences Libération
Pour réaliser ces mesures, le satellite IBUKI tourne autour de la Terre suivant une trajectoire circulaire qui passe au-dessus des pôles à l’altitude z = 667 km. Pour régler les appareils de mesure, il a fallu déterminer la durée entre deux passages successifs du satellite au-dessus de l’un des pôles.
3.2. En appliquant la deuxième loi de Newton, calculer la valeur de la période de rotation du satellite autour de la Terre, en détaillant les étapes du calcul. |
|
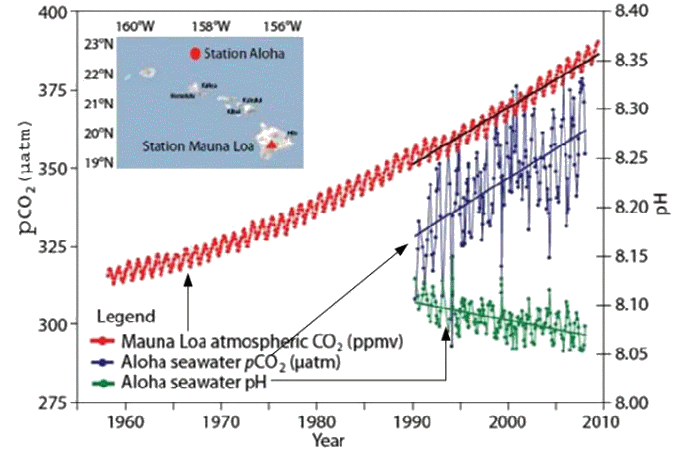
Document 1 : Évolution depuis 1958 de la composition en CO2 dans l’atmosphère à Mauna Loa (Hawaï), de la pression de CO2 dans l’océan, du pH de l’océan
La courbe représentant la concentration en dioxyde de carbone dans l’atmosphère exprimée en ppmv (partie par million par volume) n’est qu’une indication de l’évolution de cette concentration sans souci d’échelle. Afin de comparer le contenu en CO2 de l’atmosphère et de l’eau de mer, on définit la pression de CO2 dans l’océan : \(\displaystyle\mathrm{ p_{CO_2}= \frac{[CO_2]}{β} } \) où β est le coefficient de solubilité du CO2. |
|
Document 2 : Loi de Henry
La dissolution d’un gaz dans l’eau obéit à la loi de Henry selon laquelle à température constante, la concentration C du gaz dissous est proportionnelle à la pression partielle p qu’exerce ce gaz au-dessus du liquide.
CO2 (g) ⇌ CO2 (aq) |
|
Document 3 : Réactions d’équilibre des espèces carbonées
Dans les eaux de surface de l'océan, le carbone se présente sous trois formes minérales dissoutes en équilibre chimique selon les réactions ci-dessous :
|
|
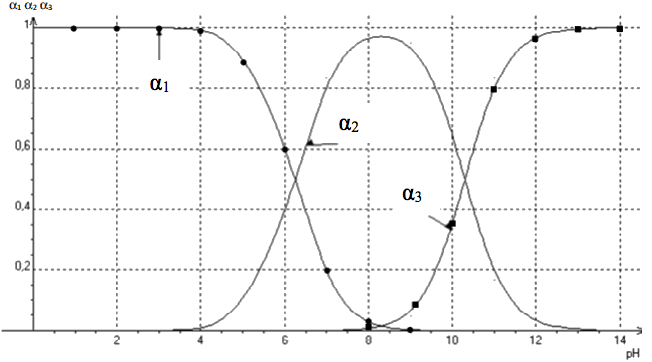
Document 4 : Variation en fonction du pH des rapports α1,α2 et α3
|
|
Document 5 : Réaction de dissolution du carbonate de calcium
En présence d’un excès de dioxyde de carbone, le carbonate de calcium CaCO3(s) se dissout selon l’équation : CaCO3 (s) + CO2 (aq) + H2O (ℓ) ⇌ Ca2+ (aq) + 2 HCO3- (aq) |