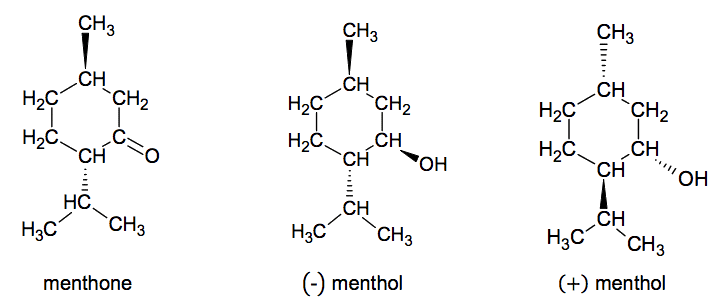|
Dans certaines boissons ou confiseries, la présence de composés extraits de la menthe procure un effet rafraîchissant, dont les publicitaires ont d'ailleurs su tirer profit, de la « Fraicheur de vivre » au « Bonbon au goût très frais ». Les scientifiques ont montré que des molécules comme celle du menthol créent la sensation de froid en activant des mécanismes sensoriels, sans qu’il y ait pour autant d’échanges thermiques.
1. Menthol et menthone
L’arôme naturel de menthe est principalement dû à trois molécules : le - menthol, la menthone et l'éthanoate de menthyle. Comme de nombreuses substances odorantes, le - menthol s'insère dans les cellules olfactives comme une clef dans une serrure, en donnant une note fraîche et
mentholée. Son stéréoisomère, le +menthol donne une sensation de moisi beaucoup moins agréable.
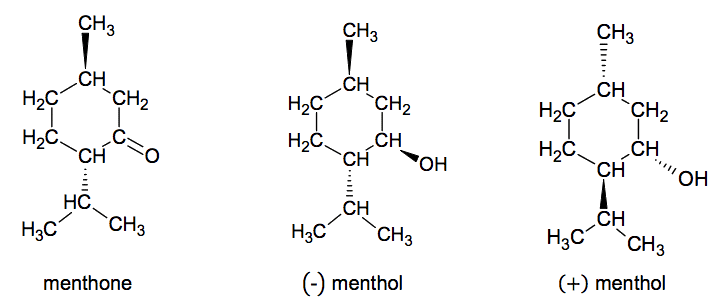
1.1. Donner la représentation topologique des molécules de menthone et de - menthol.
1.2. Repérer le(s) atome(s) de carbone asymétrique sur la représentation topologique de la menthone. Justifier.
1.3. Donner le nom du type de stéréoisomérie de configuration qui lie les deux molécules de - menthol et de + menthol. Justifier.
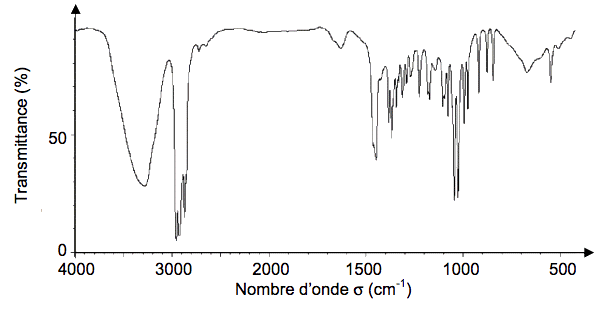
1.4. Le spectre infrarouge de la menthone et celui du menthol sont donnés ci-dessous. Choisir, en justifiant, celui correspondant à la menthone.
Spectre 1
Spectre 2
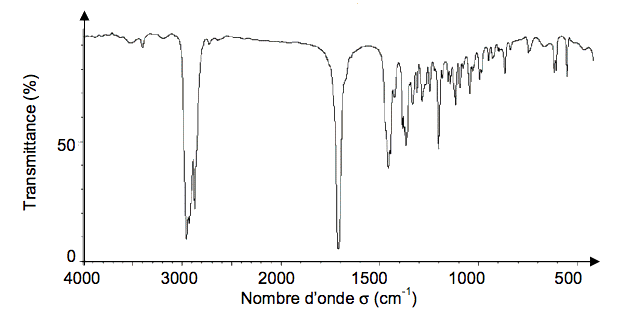
Données : bandes d’absorption en spectroscopie IR
| Liaison | C=C | C=O | O-H (acide carboxylique) | C-H | O-H (alcool) |
Nombre d’onde
(cm-1) | 1620 - 1680 | 1650- 1750 | 2500 - 3200 | 2800 - 3100 | 3200 - 3650 |
2. Synthèse d'un arôme de menthe : l’éthanoate de menthyle
L'éthanoate de menthyle, présent dans l'huile essentielle de menthe, peut être préparé à partir d’acide éthanoïque et de menthol. L'équation de la réaction de synthèse est :
| C10H20O | + | C2H4O2 | → | C12H22O2 | + | H2O |
| menthol | | acide éthanoate | | éthanoïque de menthyle | | eau |
Le protocole de cette synthèse est décrit ci-dessous :
- verser dans un ballon 15,6 g de menthol, puis, avec précaution, 11,0 mL d’acide éthanoïque pur, et enfin, quelques gouttes d’acide sulfurique concentré ;
- chauffer à reflux le mélange réactionnel durant 40 minutes environ ;
- verser le mélange obtenu dans un bécher contenant 100 mL de solution aqueuse de chlorure de sodium ;
- extraire la phase organique contenant l’éthanoate de menthyle à l’aide d’une ampoule à décanter ;
- laver la phase organique avec une solution saturée d’hydrogénocarbonate de sodium (Na+(aq) + HCO3-(aq)) : on observe une effervescence ;
- agiter prudemment quelques instants en dégazant régulièrement, puis éliminer la phase aqueuse ;
- sécher la phase organique avec du sulfate de magnésium anhydre.
Au laboratoire, en suivant ce protocole, on a obtenu une masse égale à 12 g d'éthanoate de menthyle.
Données :
| Nom | Formule brute | Masse molaire (g/mol) | Masse volumique (g/mL) | Miscibilité avec l’eau |
| Menthol | C10H20O | 156 | 0,89 | partielle |
| Acide éthanoïque | C2H4O2 | 60 | 1,05 | presque totale |
Éthanoate de menthyle
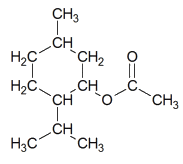 | C12H22O2 | 198 | 0,92 | très faible |
Couples acide/base :
- acide éthanoïque/ion éthanoate: CH3COOH / CH3COO-
- dioxyde de carbone/ion hydrogénocarbonate : CO2, H2O / HCO3-
2.1. Les synthèses peuvent conduire à la modification des chaînes et/ou des groupes caractéristiques. Identifier le type de modification associée à la synthèse de l’éthanoate de menthyle. Justifier.
2.2. Étude du protocole.
2.2.1. L’acide sulfurique est ajouté comme catalyseur. Préciser son action dans la synthèse.
2.2.2. Représenter le montage nécessaire à la mise en œuvre du protocole de synthèse. Le nommer et expliquer son intérêt.
2.2.3. Justifier l’utilisation d’une ampoule à décanter pour éliminer la phase aqueuse lors de la dernière étape.
2.2.4. Lors du lavage de la phase organique, l'acide éthanoïque restant réagit avec les ions hydrogénocarbonate. Écrire l'équation de cette réaction acido-basique et justifier les observations expérimentales faites.
2.3. Rendement de la synthèse.
2.3.1. Identifier le réactif introduit en excès.
2.3.2. Déterminer le rendement de la synthèse de l'éthanoate de menthyle en expliquant la démarche.
2.3.3. Proposer une explication permettant de justifier d’un rendement inférieur à 100% pour cette synthèse.
3. Menthe glaciale
Le sirop de menthe glaciale est de couleur bleu-vert (cyan). Sur l’étiquette d’une bouteille de sirop de menthe glaciale, on peut lire les indications suivantes :
Sucre, sirop de glucose-fructose, eau,
arôme de menthe, colorant : E133. |
Pour déterminer la concentration en colorant E133 du sirop de menthe :
- on dilue le sirop de menthe glaciale cinq fois : la solution obtenue est notée S ;
- on réalise une échelle de teinte composée de quatre solutions de colorant E133 de concentrations différentes.
On dispose devant un écran éclairé par une source de lumière blanche, une série de six cuves contenant :
- les quatre solutions de l’échelle de teinte notées S1, S2, S3, S4.
- de l'eau distillée (« blanc ») notée S0.
- la solution diluée de sirop de menthe notée S.
L'ensemble est photographié à l'aide d'un appareil photographique numérique.
Spectre 2
Les hypothèses de travail sont les suivantes :
- l'éclairage des cuves est uniforme ;
- les cuves sont identiques ;
- le colorant E 133 est la seule espèce colorée dans le sirop de menthe glaciale.
Le cliché en couleurs, reproduit en noir et blanc ci-après, est analysé à l'aide d'un utilitaire permettant de connaître les codes couleurs des pixels. En codage RVB 24 bits, la réponse pour la composante rouge R, la composante verte V et la composante bleue B, est traduite par un nombre compris entre 0 et 255 correspondant aux différentes nuances d’intensité lumineuse d’une même couleur.

L’absorbance associée à la composante R ou V ou B est déterminée par la relation :
\(\displaystyle\mathrm{ A= log \left( \frac{Valeur \ du \ c o d e \ d e \ l a \ c o m p o s a n t e \ c o n s i d é r é e \ d a n s \ l e \ blanc}{V a l e u r \ d u \ c o d e \ d e \ l a \ m ê m e \ c o m p o s a n t e \ d a n s \ l a \ s o l u t i o n \ c o l o r é e} \right) } \)
Les résultats obtenus pour l'échelle de teinte et le blanc sont rassemblés dans le tableau ci-dessous :
| Échelle de teinte | « Blanc » |
| Solutions | S4 | S3 | S2 | S1 | S0 |
| Concentration en (mg/L) | 24,0 | 12,0 | 6,0 | 3,0 | 0 |
Valeur du code correspondant
à la composante rouge R | 30 | 80 | 128 | 163 | 206 |
Valeur du code correspondant
à la composante verte V | 180 | 191 | 198 | 201 | 206 |
Valeur du code correspondant
à la composante bleue B | 204 | 204 | 206 | 205 | 206 |
Données :
- Loi de Beer Lambert : Pour une longueur d’onde donnée, la relation entre l’absorbance A d’une solution colorée et la concentration C massique de l’espèce colorée dans la solution absorbante s’écrit : A = k.C où k est une constante.
- Cercle chromatique :
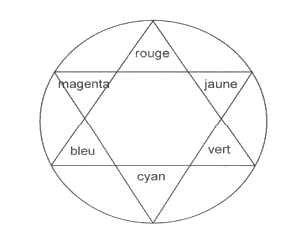
3.1. Quelle est la composante RVB la plus absorbée par une solution de sirop de menthe ? Ce résultat était-il prévisible ?
3.2. À l’aide de vos connaissances et des informations fournies, déterminer la concentration massique en colorant E133 du sirop de menthe glaciale. Toute prise d’initiative et toute démarche, même partielles, seront valorisées.
|