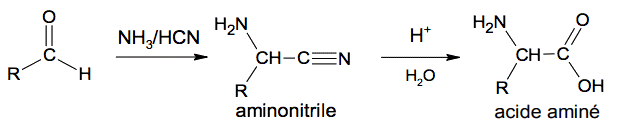Carnet de bac
Annales
A la recherche de la vie dans l'espace |
|
| Antilles 2017 - Exercice 3 - 5 points |
|
Des analyses récentes de la composition chimique de météorites indiquent que certains composés nécessaires à la vie peuvent se trouver en dehors de la Terre. Ces découvertes poussent de plus en plus les chercheurs à explorer le ciel en quête de planètes extrasolaires, motivés par l’espoir de trouver des planètes habitables et d’y détecter des traces de vie.
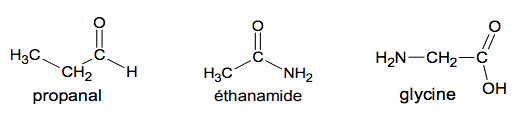
Comparaison d’électronégativités entre différents atomes : χ(O)> χ(N) > χ(C) et χ(C) =χ( H) Formules semi-développées de quelques molécules organiques :
1. Chimie et origine de la vie dans l’espace Des ingrédients considérés comme indispensables pour l’origine de la vie sur Terre ont été découverts dans l’environnement de la comète 7P Tchourioumov-Guérassimenko, que la sonde Rosetta de l’ES a exploré pendant presque deux ans. C’est le cas de la glycine, le plus simple des acides aminés, qui se trouve couramment dans les protéines, et du phosphore, un élément clé de l’ D et des membranes cellulaires. Si la nature exacte de cette matière organique cométaire est encore inconnue, des travaux en laboratoire permettent de modéliser les réactions chimiques pouvant se produire au sein des comètes. Source : Exobiologie.fr
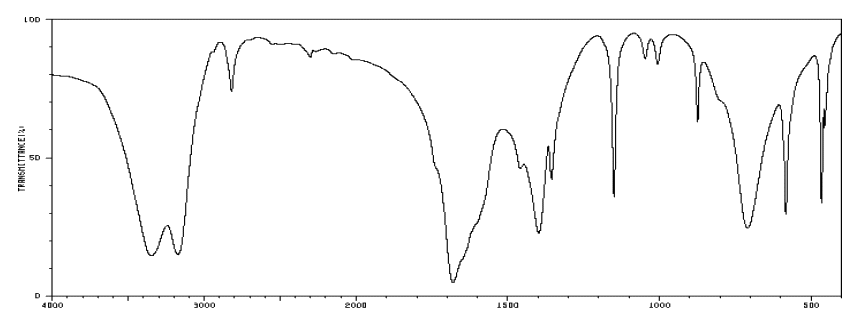
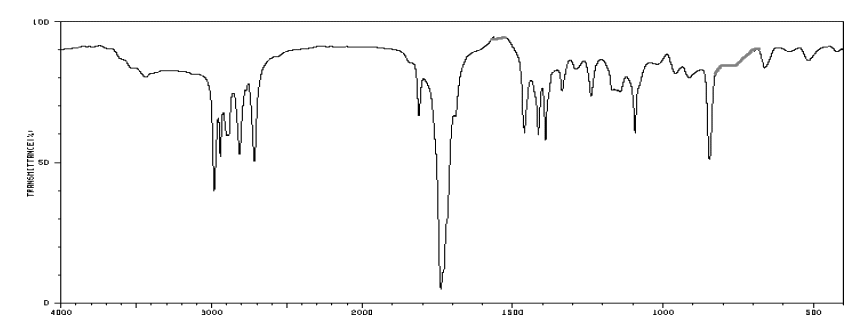
L’atterrisseur de la sonde Rosetta possède un spectromètre infrarouge (VIRTIS) capable de détecter la présence de molécules organiques. Parmi les molécules détectées sur la comète « Tchouri », plusieurs l’ont été pour la première fois dans une comète. Parmi celles-ci, on trouve le propanal et l’éthanamide.
Spectre IR n°1
Source : National Institute of Advanced Industrial Science and Technology
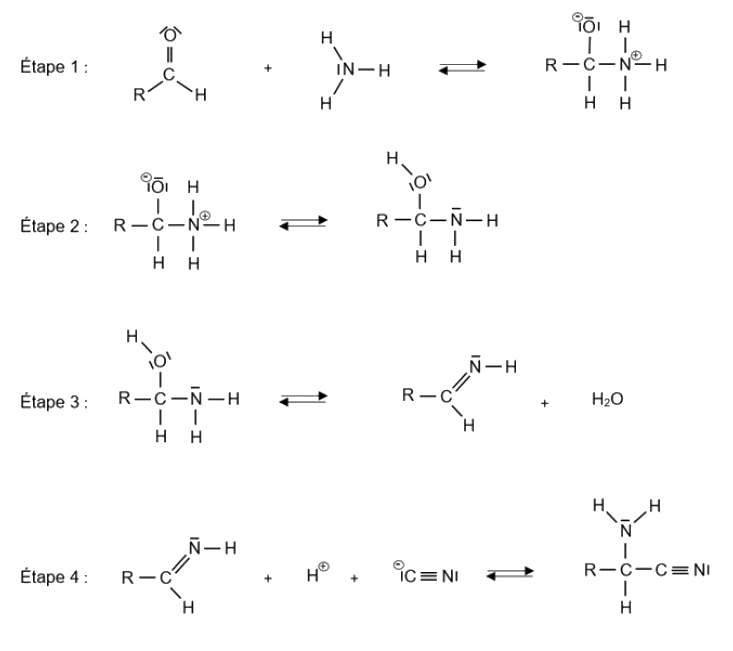
1.3. On donne ci-dessous la succession des deux réactions proposée par Adolph Strecker en 1850, pour synthétiser un acide aminé à partir d’un aldéhyde.
Le mécanisme de la première réaction se déroule en 4 grandes étapes données en annexe à rendre avec la copie.
NH3+-CH2COO-(aq) + HO-(aq) → NH2-CH2COO-(aq) + H2O(ℓ)
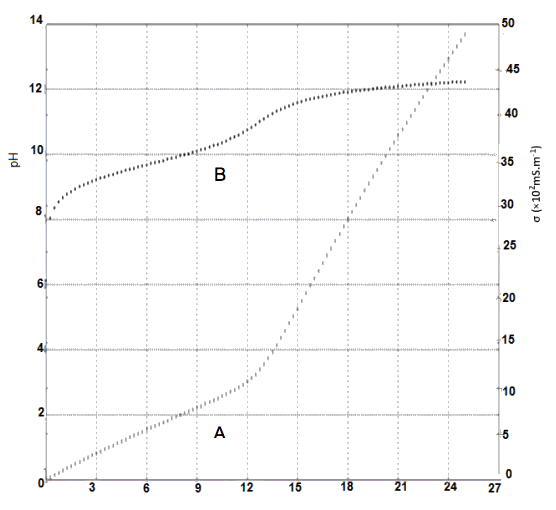
2.1 Après avoir identifié la courbe donnant la variation de la conductivité en fonction du volume de titrant ajouté, expliquer qualitativement son allure.
|
| Annexe | |
|
| |