|

Les piscines naturelles ont une structure de construction habituelle mais contrairement aux piscines classiques, l'eau ne subit pas de traitement chimique. Le système de filtration est assuré par une zone réservée à la végétation, dont la surface est au moins égale à la zone de baignade pour un meilleur équilibre écologique.
D’après le site Piscine comprendre choisir
1. Étude du fluide caloporteur d’un chauffe-eau solaire
La baignade est plus confortable si l’eau de la piscine est chauffée. L’une des solutions possibles est d’installer un chauffe-eau solaire, système qui permet de produire de l’eau chaude grâce à l’énergie solaire. Le fluide caloporteur qui circule dans le capteur solaire est un mélange d’eau et de
mono propylène glycol ; c’est un antigel, dont le nom en nomenclature officielle est propane-1,2-diol et dont la formule topologique est la suivante : 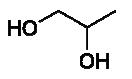
Schéma de fonctionnement du chauffe-eau solaire
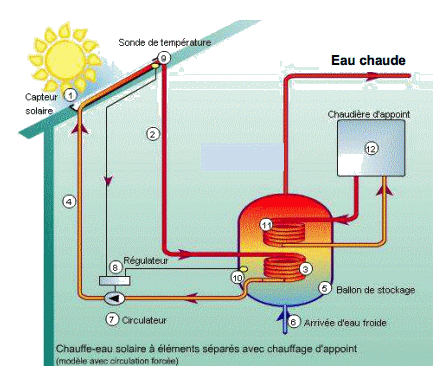
D’après le site www.vertener.fr
1.1. Quel est le mode principal de transfert thermique mis en jeu entre le capteur solaire (1) et le milieu extérieur ? En déduire la fonction de la chaudière d’appoint.
1.2. Quel est l'intérêt pour le chauffe-eau solaire d’intégrer du mono propylène glycol dans la composition du fluide caloporteur ?
1.3. Justifier le nom donné, en nomenclature officielle, au mono propylène glycol.
1.4. Justifier le fait que la molécule de mono propylène glycol possède plusieurs stéréoisomères. Donner la représentation de Cram de ces stéréoisomères et préciser le type de stéréoisomérie qui les lie. Ces stéréoisomères sont-ils chiraux ? Comment réaliser un mélange racémique ?
1.5. Déterminer le nombre de signaux que cette molécule présenterait en spectroscopie RMN du proton, ainsi que la multiplicité de ces signaux. On admettra que les protons des groupes –OH donnent le même signal et ne se couplent pas avec les autres protons de la molécule.
2. Traitement de l’eau de la piscine
La technique de traitement de l’eau d’une piscine naturelle utilise les bactéries présentes dans le système racinaire des plantes pour épurer l’eau ; il s’agit d’une phyto-épuration. Les espèces végétales sont ainsi soigneusement sélectionnées pour absorber des polluants tels que les ions nitrate et phosphate. Une pompe de circulation assure le déplacement de l’eau à travers la zone de filtration naturelle.
Schéma d’un système de phyto-épuration
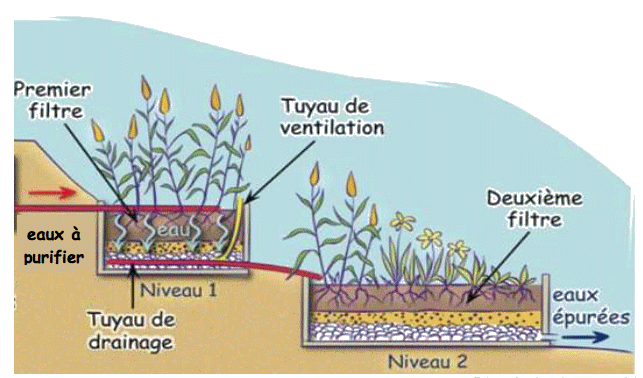
D’après le site www.bleu-vert.fr
On se propose de tester l’efficacité d’un système de phyto-épuration de ce type, en réalisant un dosage de l’azote total de la matière organique contenue dans les eaux épurées à la sortie du dernier bassin.
On prélève un échantillon d’eau de volume Vech = 20,0 mL à la sortie du dernier bassin et on met en œuvre le protocole de dosage de l’azote total par la méthode de Kjehldal. Le volume d’acide chlorhydrique versé à l’équivalence est VE = 10,3 mL.
Protocole simplifié de dosage de l’azote total Kjeldahl
Minéralisation : La transformation chimique se fait à une température de 421°C en présence de sulfate de cuivre avec un excès d’acide sulfurique. L’azote contenu dans la matière organique est dégradé sous forme d’ions ammonium NH4+(aq) .
Distillation : Un excès de soude est introduit dans le mélange obtenu après minéralisation pour amener le pH de la solution à 12 et transformer les ions ammonium NH4+(aq) en molécules d’ammoniac NH3(aq), qui sont entrainées par la vapeur d’eau lors d’une distillation.
Titrage : Le titrage de l’ammoniac NH3(aq) présent dans le distillat est réalisé par une solution d’acide chlorhydrique (H3O+(aq) + Cl-(aq)), de concentration molaire Cac égale à 2,0·10-3 mol·L-1, jusqu’au virage d’un indicateur coloré bien choisi.
Données
- Numéros et masses molaires atomiques de quelques atomes :
|
H |
N |
O |
| Z |
1 |
7 |
8 |
| M (g.mol-1) |
1,0 |
14 |
16 |
- pKa de quelques couples acido-basiques à 25 °C : H2O(ℓ) / HO(aq) : 14 H3O+(aq) / H2O(ℓ) : 0 NH4+(aq) / NH3(aq) : 9,2
- Zones de virage de quelques indicateurs colorés :
| Indicateur |
pKa |
Couleur acide |
Zone de virage |
Couleur basique |
| Orange de méthyle | 3,7 | rouge | 3,2 – 4,4 | jaune |
| Vert de bromocrésol | 4,7 | jaune | 3,8 – 5,4 | bleu |
| Rouge de méthyle | 5,1 | jaune | 4,8 – 6,0 | rouge |
| Bleu de bromothymol | 7,0 | jaune | 6,0 – 7,6 | bleu |
| Rouge de phénol | 7,9 | jaune | 6,8 – 8,4 | rouge |
| Phénolphtaléine | 9,4 | incolore | 8,2 -10,0 | violet |
- Normes européennes de rejets pour les eaux résiduaires :
- Matière en suspension (MES) < 35 mg·L-1
- Demande chimique en oxygène (DCO) < 125 mg d’oxygène dissous
- Demande biologique en oxygène sous 5 jours (DBO5) < 25 mg d’oxygène dissous au bout de 5 jours
- L’azote total Kjeldahl (NtK) : masse totale d’azote N < 20 mg·L-1
D’après le site www.recycleau.fr
2.1. Quelle propriété les transformations chimiques mises en jeu dans la méthode de Kjeldahl doivent-elles toutes avoir pour que l’on puisse doser l’intégralité de l’azote présent dans l’échantillon ?
2.2. Justifier le fait que NH4+(aq) et NH3(aq) forment un couple acide-base et préciser quelle est la forme acide et quelle est la forme basique.
2.3. Lors de l’étape de distillation du protocole simplifié de dosage de l’azote total Kjeldahl, pourquoi un pH égal à 8 pourrait-il ne pas convenir ?
2.4. Le suivi pHmétrique du titrage de l’ammoniac par l’acide chlorhydrique dans des conditions analogues, conduit au tracé du graphe représenté ci-dessous.
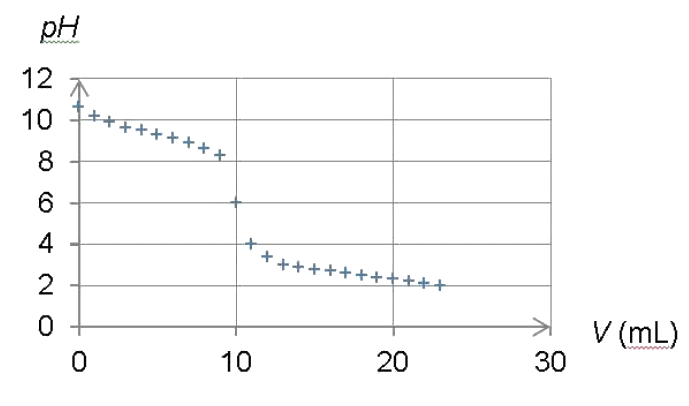
2.4.1. Quelle est l’espèce majoritaire dans le bécher au début du titrage ? Même question à la fin du titrage.
2.4.2. En déduire l’équation de la réaction chimique support du titrage.
2.4.3. Citer un indicateur coloré à utiliser dans la méthode de Kjeldahl. Justifier.
2.5. L’eau résiduaire est-elle conforme aux normes européennes en ce qui concerne l’azote total Kjeldahl ?
Le candidat est évalué sur ses capacités à concevoir et à mettre en œuvre une démarche de résolution.
|






