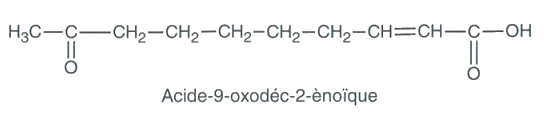|
A. La communication chez les abeilles
L’absence de détection des sons, le peu de sensibilité au toucher, et la déficience de la vue dans l’obscurité de la ruche sont remplacés chez l’abeille par des émissions chimiques comme les phéromones. Ces substances sont produites par tous les individus d’une ruche. La transmission du message chimique induit un changement de comportement des abeilles qui le perçoivent.
1. La phéromone mandibulaire de la reine
Cette phéromone est composée d’un mélange de 5 espèces chimiques. Une de ces espèces identifiée chez l’abeille domestique, et notamment chez la reine, est l’acide (2E)-9-oxodéc-2-ènoïque dont la formule semi-développée est représentée ci-dessous. Elle assure la cohésion de la colonie en commandant aux ouvrières de nourrir la reine, de la toiletter.
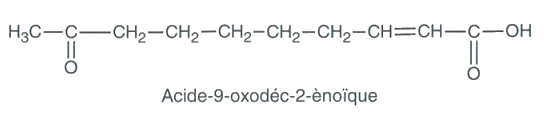
1.1. Recopier la molécule de l’acide 9-oxodéc-2-ènoïque, encadrer les groupes caractéristiques présents et nommer les familles des fonctions correspondantes.
1.2. La molécule d’acide 9-oxodéc-2-ènoïque possède deux stéréoisomères de configuration. Les représenter.
Une autre de ces espèces chimiques, l’acide 9-hydroxydéc-2-èneoïque, de formule relativement semblable à la précédente, est émise lors du vol nuptial par la reine pour attirer les mâles.
1.3. Le groupe caractéristique hydroxy étant −OH, représenter l’acide 9-hydroxydéc-2-èneoïque par analogie avec l’acide 9-oxodéc-2-ènoïque.
1.4. La molécule d’acide 9-hydroxydéc-2-èneoïque présente deux types de stéréoisomérie de configuration. Justifier.
2. Phéromone d’alarme et phéromone d’attaque
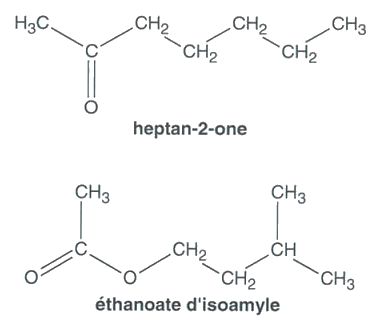
Une des phéromones d’alarme est l’heptan-2-one. Elle est émise, entre autres, quand un intrus s’approche de la ruche ou qu’une abeille est agressée. La réaction d’alerte est immédiate dans la colonie, mais de courte durée.
La phéromone d’attaque est l’éthanoate d’isoamyle. C’est une espèce chimique volatile qui est produite par des cellules bordant la poche à venin. C’est pourquoi, si une abeille pique, les glandes sécrétant cette phéromone restent avec le dard et continuent à émettre le signal d’attaque.
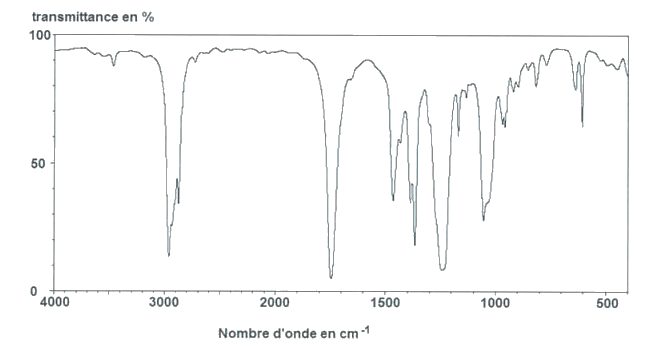
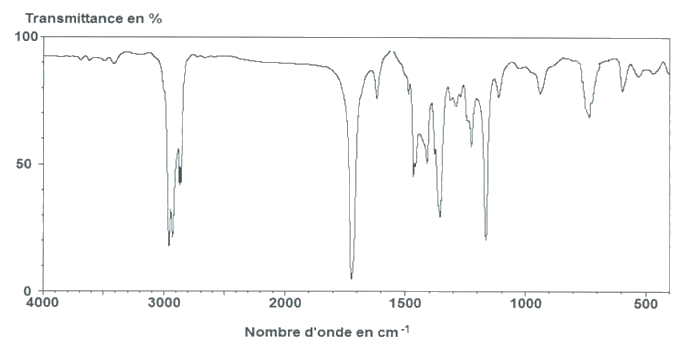
Pour distinguer ces deux phéromones, on peut avoir recours à la spectroscopie infrarouge.
Spectre IR n°1
Spectre IR n°2
Bandes d’absorption IR de quelques types de liaisons chimiques
| Liaison O−H |
Entre 3100 et 3500 cm-1 |
Bande forte et large |
| Liaison O−H des acides carboxyliques |
Entre 2500 et 3300 cm-1 |
Bande forte et large |
| Liaison C−H |
Entre 2900 et 3100 cm-1 |
Bande moyenne à forte |
| Liaison C−H de CHO |
Entre 2650 et 2800 cm-1 |
Double bande moyenne |
| Liaison C=O |
Entre 1700 et 1800 cm-1 |
Bande forte |
| Liaison C−O |
Entre 1200 et 1300 cm-1 |
Bande forte |
Ces spectres ne peuvent être distingués que grâce aux bandes d’absorption dont le nombre d’onde est compris entre 500 et 1500 cm-1.
2.1. Attribuer à chaque spectre la molécule de phéromone correspondante, en expliquant votre choix.
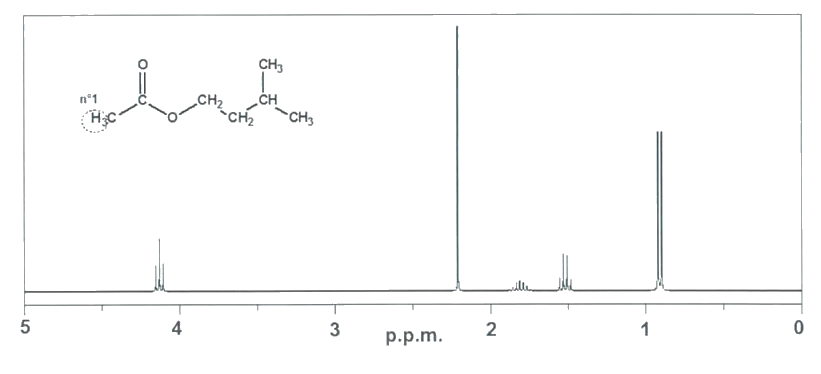
Le spectre RMN de l’éthanoate d’isoamyle est représenté ci-dessous. Il comporte :
- Un doublet à 0,9 ppm
- Un quadruplet à 1,5 ppm
- Un nonuplet (9 pics) à 1,8 ppm
- Un singulet à 2,2 ppm
- Un triplet à 4,1 ppm
2.2. Repérer et numéroter les groupes de protons équivalents de la molécule d’éthanoate d’isoamyle, comme débuté ci-dessous avec l’exemple du groupe n°1 et justifier que le spectre correspond bien à la phéromone d’attaque.
Spectre RMN de l’éthanoate d’isoamyle
B. Le miel source de nourriture
Le miel est la substance naturelle sucrée produite par les abeilles Apis mellifera. On distingue principalement :
• le miel de nectar : miel qui provient des nectars de plantes ;
• le miel de miellat : miel qui provient principalement d’excrétions d’insectes butineurs laissées sur les parties vivantes de plantes ou de secrétions de parties vivantes de plantes.
Les normes alimentaires internationales spécifient que la teneur en sucres réducteurs (glucose, fructose) doit être au minimum de :
• 60 g pour 100 g pour les miels de nectar ;
• 45 g pour 100 g pour les miels de miellat.
On souhaite doser les sucres réducteurs d’un miel de sapin (miel de miellat) par une méthode spectrophotométrique en utilisant un indicateur de présence de sucres réducteurs, le DNS.
Données
• Le DNS ou acide 3,5-dinitrosalicylique présente une forme oxydée de couleur jaune qui réagit de la même façon avec le fructose ou le glucose et se transforme en une forme réduite de couleur rouge.
• Le spectre d’absorption UV-Visible de la forme réduite du DNS présente un maximum d’absorption à la longueur d’onde λ = 530 nm.
Protocole utilisé :
• préparer des solutions étalons de glucose dans une solution de DNS en excès ;
• mesurer l’absorbance A de solutions étalons de glucose dans une solution de DNS en excès à la longueur d’onde λ = 530 nm ;
• réaliser 50,0 mL d’une solution S0, solution aqueuse de miel contenant 0,60 g de miel de sapin ;
• diluer 10 fois la solution S0 dans une solution de DNS en excès ; Soit S1 la solution obtenue.
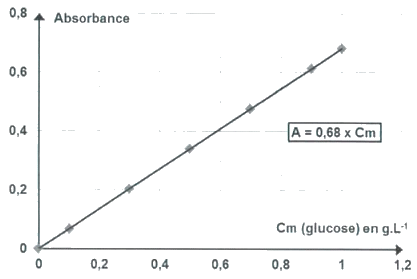
Résultats expérimentaux :
Absorbance de la solution S1 à la longueur d'onde λ= 530 nm.
AS1=0,40.
1. Expliquer pourquoi le DNS doit être introduit en excès.
2. Ce miel satisfait-il à la norme internationale ?
|