|
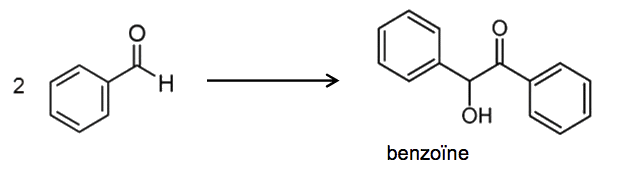
La benzoïne est une molécule utilisée dans de nombreux domaines de l’industrie chimique, en pharmacologie et cosmétique par exemple. Le but de cet exercice est d’étudier trois protocoles de synthèse de la benzoïne à partir du benzaldéhyde et de les comparer, au regard de la chimie verte. L’équation de la réaction de synthèse est représentée ci-dessous :
| Espèce chimique |
Caractéristiques |
Pictogramme de sécurité |
Benzaldéhyde
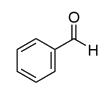 |
Tfusion = -26 ° C
Tébullition = 179 ° C
Masse volumique à 20 ° C : ρ = 1,04 g·mL-1
Légèrement soluble dans l’eau
Soluble dans l’éthanol
Masse molaire : 106 g·mol-1
|
 |
Benzoïne
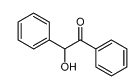 |
Tfusion = 137 ° C
Peu soluble dans l’eau
Légèrement soluble dans l’éthanol
Masse molaire : 212 g·mol-1
|
|
| Cyanure de potassium KCN |
Tfusion = 635 ° C
Donne des ions K+ et CN– par dissolution dans l’eau
Soluble dans l’eau et l’éthanol
Masse molaire : 65 g·mol-1
|

En milieu acide, un dégagement gazeux de HCN (gaz toxique) |
Thiamine (vitamine B1)
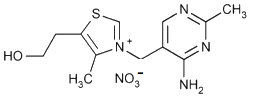 |
Tfusion = 248 ° C (décomposition)
Soluble dans l’eau et l’éthanol.
Masse molaire : 265 g·mol-1
|
|
Ethanol
CH3−CH2−OH
|
Tfusion = -114 ° C
Tébullition = 78 ° C
Masse volumique à 20 ° C : ρ = 0,79 g·mL-1
Masse molaire : 46,1 g·mol-1
|
 |
1. Les molécules intervenant dans la synthèse
Recopier l’équation de la réaction de synthèse. Entourer les groupes caractéristiques du réactif et du produit, puis nommer les fonctions correspondantes.
2. La méthode ZININ 1839
La méthode ZININ est l’une des premières méthodes de synthèse de la benzoïne à partir du benzaldéhyde, utilisant les ions cyanure comme catalyseurs.
Protocole de la synthèse :
 |
Travailler sous une hotte aspirante.
Porter constamment une paire de gants de protection.
Récupérer les déchets dans un récipient de stockage approprié.
|
- Dans un ballon à fond rond de 250 mL équipé d'un réfrigérant, introduire environ 20 mL d'éthanol, 15,0 mL de benzaldéhyde et 15,0 mL d'une solution aqueuse à 10% en cyanure de potassium.
- Chauffer à reflux durant 30 minutes.
- Refroidir le ballon et son contenu dans un mélange (eau + glace + sel) : la benzoïne cristallise.
- Filtrer sur filtre Büchner.
- Laver le résidu solide avec 50 mL d'eau distillée glacée.
- Essorer et sécher à l'étuve réglée à 100 ° C pendant 20 minutes.
- Recristalliser le produit brut dans l'éthanol.
- Filtrer sur filtre Büchner.
- Essorer et sécher à l'étuve réglée à 100 ° C durant 20 minutes.
- Mesurer la température de fusion et la masse de benzoïne solide obtenue.
Résultats : Tfusion = 137 ° C ; mobtenue = 7,81 g
2.1. Analyse du protocole de synthèse.
2.1.1. Justifier les mesures de sécurité préconisées.
2.1.2. Dans un protocole de synthèse apparaissent quatre étapes : synthèse – séparation – purification – identification. Repérer ces différentes étapes successives dans les opérations du protocole de synthèse de la benzoïne notées de 1. à 10.
2.1.3. Justifier le choix de la température de l’étuve.
2.2. Rendement de la synthèse.
2.2.1. Montrer que la masse maximale mthéorique de benzoïne que l’on peut former à l’issue de la synthèse vaut : mthéorique = 15,6 g.
2.2.2. Définir, puis calculer le rendement de la synthèse réalisée au laboratoire.
3. Utilisation du four à micro-onde pour la synthèse
Ronald Breslow a découvert en 1950 que l’on pouvait remplacer, dans la synthèse de la benzoïne, les ions cyanure par la thiamine (vitamine B1) comme catalyseur en milieu basique.
À partir de 1980, le chauffage au four à micro-ondes a remplacé le chauffage à reflux dans cette synthèse.
Dans un four à micro-ondes domestique, un magnétron (générateur de micro-ondes) émet des ondes électromagnétiques d’hyperfréquences (f = 2,45 GHz) canalisées dans un guide d’ondes pour arriver au-dessus du plateau tournant. Ces ondes sont ensuite dispersées par réflexions multiples sur les parois.
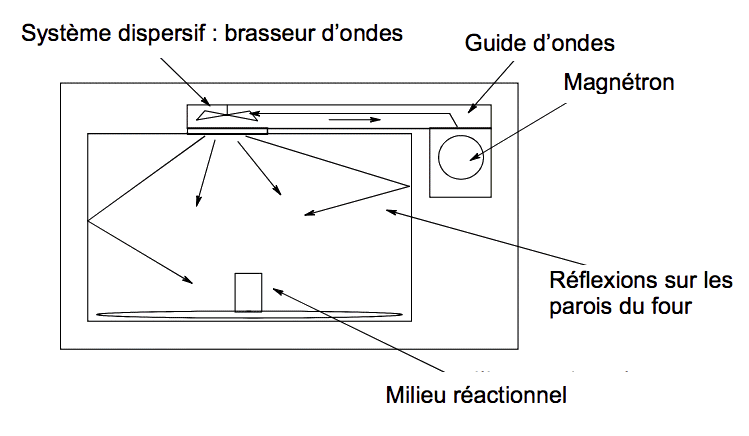
L’interaction entre les ondes électromagnétiques et les molécules du milieu réactionnel peut être modélisée par l’absorption par les molécules de photons associés aux ondes électromagnétiques. Selon l’énergie du photon absorbé, l’effet diffère, comme indiqué dans le tableau ci-dessous.
| Énergie du photon absorbé |
Nature de la transition mise en jeu |
Effet sur les molécules |
| 1,5 eV à 10 eV |
Transition entre niveaux d’énergie électronique |
Les électrons changent de niveaux, la molécule peut s’ioniser. |
| 0,003 eV à 1,5 eV |
Transition entre niveaux d’énergie vibrationnelle |
Les liaisons de la molécule vibrent selon différents modes. |
1·10-6 eV à 0,003 eV |
Transition entre niveaux d’énergie rotationnelle |
La molécule tourne sur elle-même. |
Données :
- Constante de Planck : h = 6,63·10-34 J·s
- 1 eV = 1,602·10-19 J.
Quel est l’effet produit sur les molécules du milieu réactionnel par les ondes
électromagnétiques émises dans le four à micro-ondes ? Un calcul est attendu.
4. Comparaison des différents protocoles
Le tableau suivant récapitule différents protocoles de synthèse ramenés à une quantité équivalente de benzaldéhyde de départ.
| Année du protocole |
Substances chimiques |
Chauffage |
Masse de benzoïne obtenue |
| 1839 |
Benzaldéhyde 15 mL
Ion cyanure
Éthanol + eau (solvant) |
à reflux
durée = 30 min
puissance = 250 W |
7,8 g |
| 1950 |
Benzaldéhyde 15 mL
Thiamine (milieu basique)
Éthanol + eau (solvant) |
à reflux
durée = 90 min
puissance = 100 W |
7,4 g |
| 1980 |
Benzaldéhyde 15 mL
Thiamine (milieu basique)
Éthanol + eau (solvant) |
au four micro-onde
durée = 7 min
puissance = 600 W |
9,0 g |
En quoi l’évolution du protocole de cette synthèse va-t-il dans le sens de la chimie verte ? La réponse devra comporter un argument environnemental et un argument énergétique.
Donnée :
- Relation entre puissance P (en W) et énergie E (en J) : E = P.∆t.
- ∆t est la durée du transfert d’énergie, exprimée en s.
|