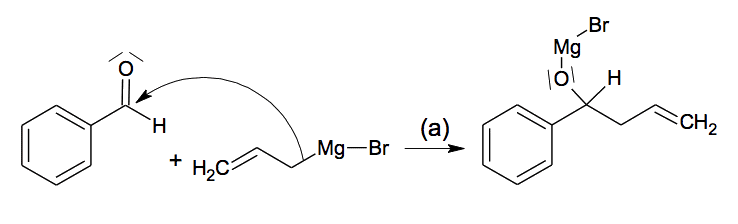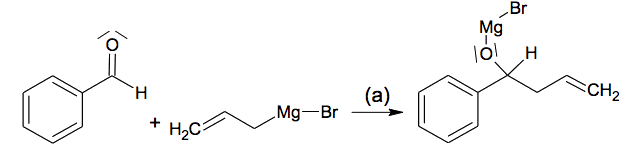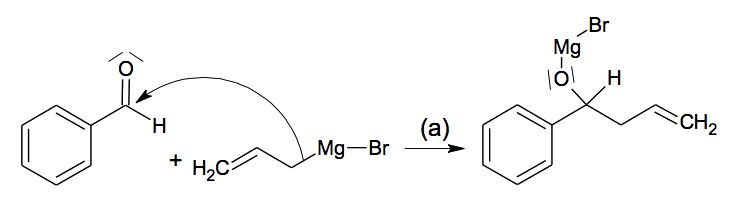|
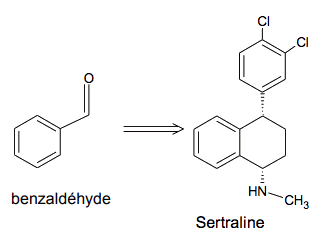
Le benzaldéhyde est un liquide incolore, couramment utilisé comme additif alimentaire pour son odeur d’amande amère. Il s’avère également être d’une grande utilité en chimie organique de synthèse ; cet exercice cherche à étudier quelques aspects de la synthèse d’une molécule d’intérêt biologique, la sertraline (antidépresseur), à partir du benzaldéhyde. Une voie de synthèse propose de synthétiser, en 9 étapes, la sertraline à partir du benzaldéhyde.
La première partie s’intéresse à la pureté du benzaldéhyde utilisé comme réactif. Dans une deuxième partie, quelques-unes des 9 étapes de la voie de synthèse sont analysées. Enfin, dans une troisième partie une alternative à deux étapes sensibles est étudiée.
Données :
- Benzaldéhyde :
- Masse molaire moléculaire : M = 106 g·mol-1
- Masse volumique : ρ = 1,05 g·mL-1
- Couples acide-base :
- L’acide benzoïque appartient au couple : (C7H6O2/ C7H5O2-)
- Pureté d’un réactif :
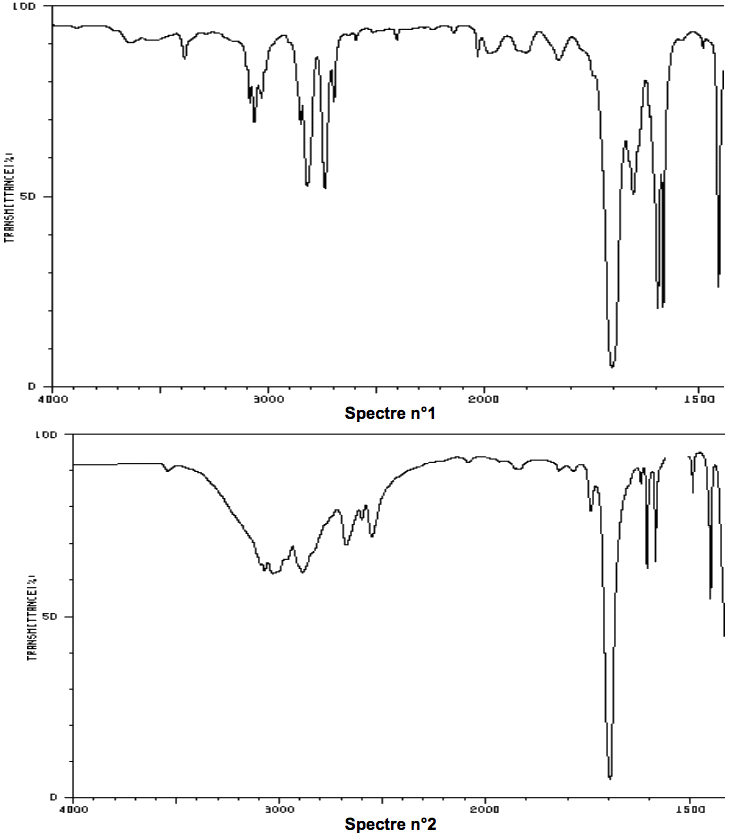
- Table simplifiée en spectroscopie IR :
| Liaison | Nombre d’onde (cm-1) | Intensité |
| O-H alcool | 3200 - 3400 | Forte, large |
| O-H acide carboxylique | 2500 - 3200 | Forte à moyenne, large |
| Ctri-H | 3000 - 3100 | Moyenne |
| Cal-H | 2750-2900 | Moyenne, parfois 2 bandes |
| C=O aldéhyde et cétone | 1650 - 1730 | Forte |
| C=O acide | 1680 - 1710 | Forte |
| C=C aromatique | 1450-1600 | Variable, 3 à 4 bandes |
Remarques :
Ctri signifie un atome de carbone relié à 3 voisins (C trigonal).
Cal signifie un atome de carbone de la fonction aldéhyde.
C=C aromatique symbolise les liaisons carbone-carbone d’un cycle aromatique comme ci-contre : 
- Zone de virage de quelques indicateurs colorés :
| Nom | Zone de virage | Couleur de la forme acide | Couleur de la forme basique |
| Hélianthine | 3,1 - 4,4 | Rouge | Jaune |
| Bleu de thymol | 8,0 – 9,6 | Jaune | Bleu |
| Bleu de Nil | 10,1 – 11,1 | Bleu | Rouge |
Partie 1 : pureté du benzaldéhyde
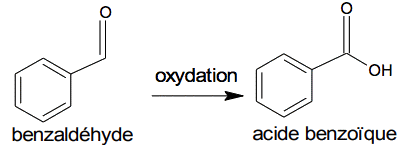
Le benzaldéhyde étant susceptible de s’oxyder en acide benzoïque lorsque le flacon est entamé, il convient de vérifier sa pureté avant de l’utiliser comme réactif.
1.1. Sur les molécules de benzaldéhyde et d’acide benzoïque reproduites dans l’annexe à rendre avec la copie, entourer les groupes caractéristiques et nommer les fonctions correspondantes.
1.2. En expliquant la démarche suivie, associer à chaque molécule (benzaldéhyde et acide benzoïque) un des spectres infrarouge reproduits ci-dessous.

Pour vérifier la pureté du benzaldéhyde qu’il va utiliser pour une synthèse, un élève réalise dans son lycée la chromatographie sur couche mince (CCM) de la solution contenue dans un flacon entamé de benzaldéhyde. Il obtient le chromatogramme ci-contre, où B correspond au point de dépôt de la solution contenue dans le flacon de benzaldéhyde et AB correspond au point de dépôt d’acide benzoïque.
1.3. Expliquer ce que la CCM permet de conclure.
L’élève cherche à déterminer quantitativement la pureté du benzaldéhyde dans le flacon entamé. Pour cela, il réalise le titrage de 10,0 mL de solution prélevée dans le flacon de benzaldéhyde par une solution aqueuse d’hydroxyde de sodium, (Na+(aq) + HO-(aq)), de concentration molaire 1,00 mol·L-1.
1.4. Citer la définition d’un couple acide-base et d’une réaction acido-basique.
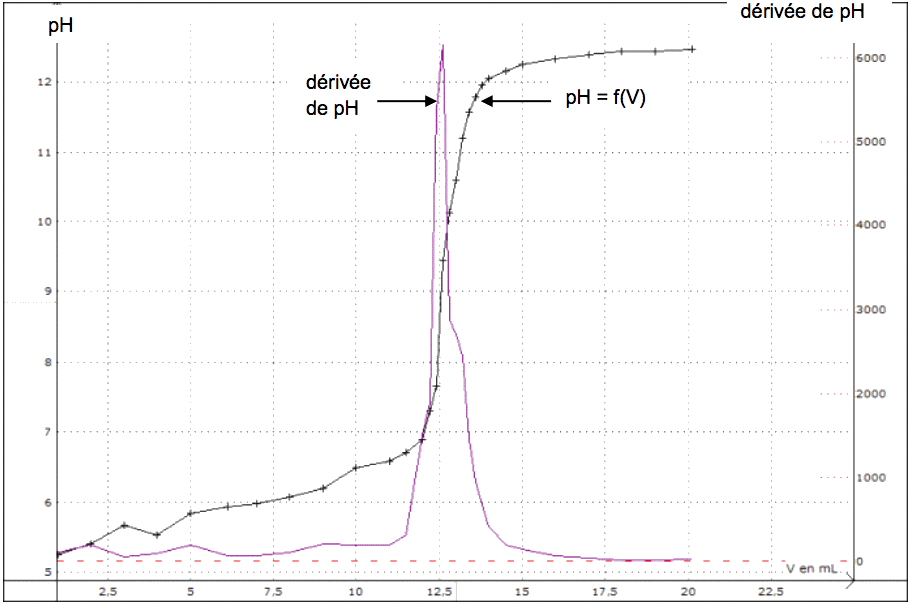
1.5. Écrire l’équation de la réaction support de titrage entre l’acide benzoïque et les ions hydroxyde. Le titrage étant suivi par pHmétrie, l’élève a tracé la courbe pH = f(V) et la courbe « dérivée de pH » (notée dpH dV ) en fonction de V.
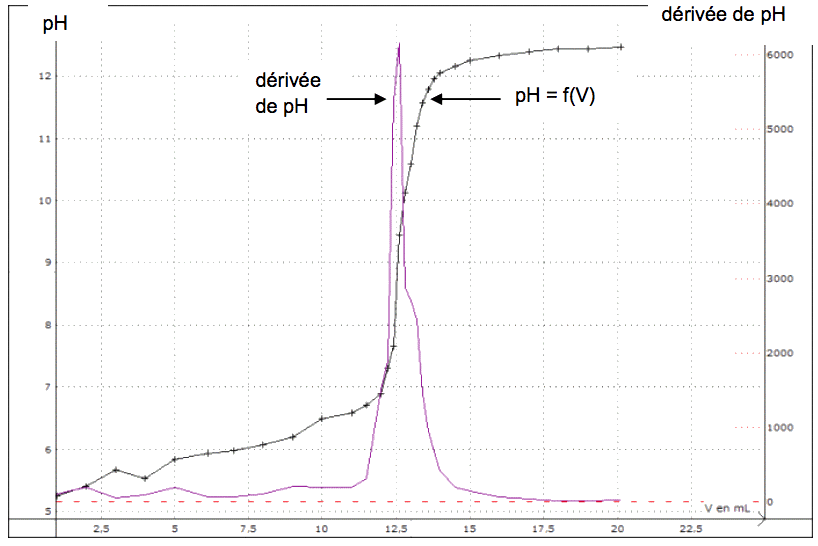
1.6. Déterminer la quantité de matière d’acide benzoïque présente dans le volume de solution prélevée en explicitant la méthode utilisée à l’aide des graphiques donnés dans l’annexe à rendre avec la copie.
1.7. Déterminer la quantité de matière de benzaldéhyde présente dans 10,0 mL de benzaldéhyde pur.
1.8. En déduire la valeur de la pureté de la solution du flacon entamé de benzaldéhyde.
1.9. Expliquer quel indicateur coloré choisir si l’on souhaitait effectuer le même titrage à l’aide d’un suivi colorimétrique. Indiquer le changement de couleur qui permettrait alors de repérer l’équivalence.
Partie 2 : étude des deux premières étapes de la synthèse de la sertraline à partir du benzaldéhyde
Les deux premières étapes de la synthèse de la sertraline sont présentées ci-dessous :
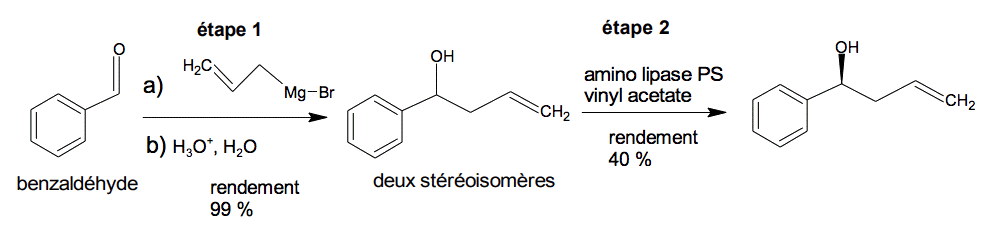
D’après Org. Lett. 2011, 13, 5740
L’étape 1 de la synthèse comporte en fait deux étapes (a) et (b) :
L’étape (a) correspond à la réaction entre l’aldéhyde et le bromure d’allylmagnésium :
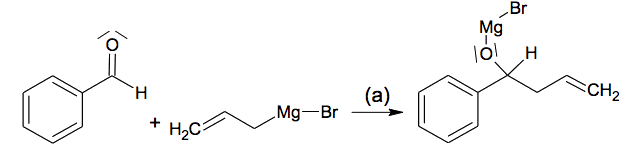
Une hydrolyse acide permet ensuite d’obtenir l’alcool lors de l’étape (b) :
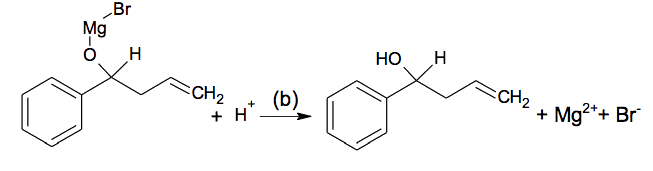
Données :
Électronégativité de quelques éléments (échelle de Pauling) :
| Élément | C | H | O | Mg | Br |
| Électronégativité | 2,55 | 2,20 | 3,44 | 1,31 | 2,96 |
2.1. Déterminer, pour les réactifs de l’étape (a), si le carbone lié au Mg dans le bromure d’allylmagnésium est un site donneur ou attracteur d’électrons. Répondre à la même question pour le carbone du groupement carbonyle du benzaldéhyde.
2.2. Compléter, dans l’annexe à rendre avec la copie, le mécanisme réactionnel de l’étape (a) ci-dessous, en indiquant la ou les flèche(s) courbe(s) manquante(s).
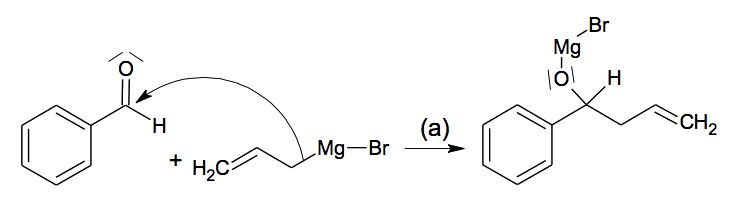
2.3. À l’issue de l’étape (b), on obtient deux stéréoisomères : les représenter sur la copie en utilisant la représentation de Cram, puis, préciser en le justifiant le type de relation de stéréoisomérie qui les lie.
2.4. L’obtention de deux stéréoisomères, dont les effets biologiques peuvent être différents, est problématique pour la synthèse d’un médicament. En déduire l’intérêt de l’étape 2.
Partie 3 : Variantes proposées pour deux étapes de la synthèse
Pour réaliser la première étape, une variante présentée ci-dessous peut être envisagée.
Variante de l’étape 1
Cette variante fait intervenir la réaction de Barbier qui utilise du zinc :
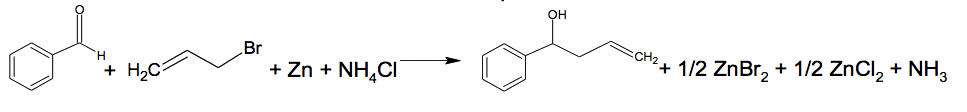
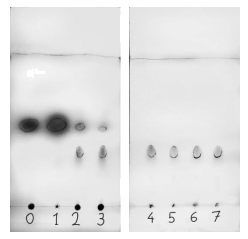
L’avantage de la réaction de Barbier résulte du fait qu’il s’agit d’une réaction « one pot », c’est-à-dire que tous les réactifs sont mélangés au départ dans le milieu réactionnel (à t = 0 min). On peut suivre la cinétique de la réaction par CCM, en prélevant toutes les minutes 1 mL environ du milieu réactionnel et en réalisant une extraction de la phase organique avec un peu d’éther. Les CCM ci-contre ont été obtenues en réalisant des dépôts de la phase organique à différentes dates de prélèvement (de t = 0 à 7 minutes) et une révélation sous UV.
3.1. Évaluer la durée de la réaction en expliquant le raisonnement.
Variante de l’étape 7
L’étape 7 de la synthèse de la sertraline, présentée ci-dessous, correspond à une oxydation de Jones, pour laquelle l’oxydant est de l’acide chromique :
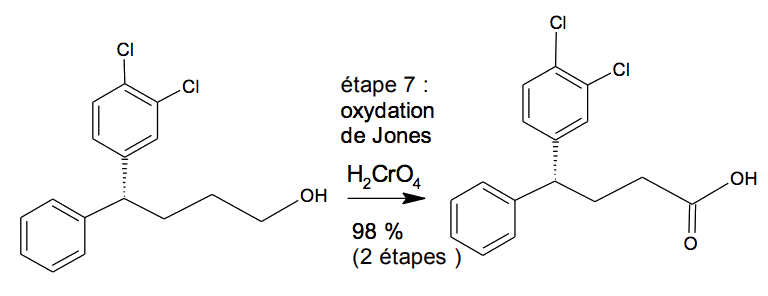
D’après Org. Lett. 2011, 13, 5740
Une variante dite « verte » peut être envisagée, en utilisant une solution à 30 % de peroxyde d’hydrogène H2O2 (couplée à un catalyseur). Cette variante verte a été effectuée avec le réactif ci-dessous:
| Réactif
 | Produit
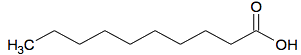 |
| Formule brute | C10H22O | C10H20O2 |
| Masse molaire moléculaire | 158 g·mol-1 | 172 g·mol-1 |
| Masse des réactifs utilisés et du produit obtenu | 100 g | 96 g |
D’après R. Noyori, Green oxidation with aqueous hydrogen peroxide, Chem. Comm, 2003, 1977-1986
Données :
- Une oxydation correspond à une perte d’électron(s).
- Informations sur l’oxydant employé lors de l’étape 7 ou de sa variante : L’acide chromique H2CrO4 contient du chrome à l’état d’oxydation (VI). Le peroxyde d’hydrogène en solution aqueuse est corrosif, mais les dangers varient selon la concentration de la solution employée :
| Espèce chimique | Composés du chrome (VI) | Peroxyde d’hydrogène en solution aqueuse |
| Classement | Cancérogène catégorie 1B Potentiel cancérigène probable pour l’être humain | Corrosif | Corrosif |
| Pictogramme |  |  |  |
| Mention d’avertissement | Danger | Danger | Attention |
| Mention de danger | Peut provoquer le cancer ou peut provoquer le cancer par inhalation | Provoque de graves brûlures de la peau et des lésions oculaires | Provoque une irritation cutanée |
| Seuil | > 0,1 % | > 35 % | 8 – 35 % |
3.2. Écrire la réaction d’oxydo-réduction mise en jeu dans la variante, l’eau oxygénée étant transformée en eau. Montrer qu’il s’agit d’une oxydation pour l’espèce organique
3.3. Déterminer le rendement de l’oxydation dans la variante verte, l’eau oxygénée étant introduite en excès. Peut-on apporter une conclusion quant à l’intérêt de la variante verte en termes de rendement ?
3.4. Donner un argument qui explique pourquoi cette variante verte est plus compatible avec la notion de chimie durable que l’oxydation de Jones.
|