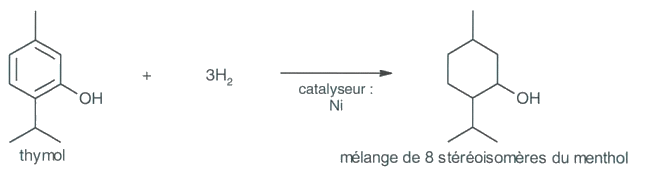|
Le menthol est l’arôme le plus vendu au monde (20 000 tonnes/an). Il est utilisé dans les industries alimentaires, cosmétiques, pharmaceutiques et dans l’industrie du tabac pour ses effets, en particulier rafraîchissant, désinfectant et anesthésique. À l’origine, le menthol pur n’était obtenu que par extraction à partir de différentes variétés de menthe cultivée. La demande mondiale croissante et l’insuffisance de la production agricole (13 000 tonnes/an) ont conduit les chimistes à synthétiser cette molécule. Mais imiter la nature n’est pas chose aisée : en effet, la menthe extraite des plantes ne contient qu’une des formes de la molécule de menthol, le (-)-menthol. Seule cette forme a une forte action rafraîchissante ; son énantiomère, le (+)-menthol, a, quant à lui, une odeur de moisi. Les chimistes ont donc dû inventer des procédés qui fabriquent sélectivement le (-)-menthol. La catalyse asymétrique, développée notamment par une équipe menée par Ryoji Noyori pour laquelle il a obtenu le prix Nobel de chimie en 2001, en est l’aboutissement.
D’après Chemwiki
Données :
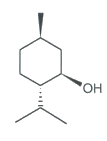
- Molécule de (-)-menthol.
- Formule brute : C10H20O
- Formule topologique en représentation de Cram :
- Masse molaire atomique M(H) = 1,0 g·mol-1 M(C) = 12,0 g·mol-1 M(O) = 16,0 g·mol-1
Catalyse asymétrique
Une synthèse asymétrique consiste à synthétiser par exemple un produit sous la forme d’un énantiomère, en partant d’une matière première achirale. Cette transformation nécessite l’utilisation d’un catalyseur chiral ou l’ajout d’un intermédiaire chiral qui est temporairement lié au réactif ; dans le premier cas, on parle alors de catalyse asymétrique.
Deux des douze principes de la chimie verte
- Principe n°2 : Économie d’atomes.
Mise en œuvre de méthodes de synthèse qui incorporent dans le produit final tous les atomes entrant dans le processus (ou la plupart d’entre eux).
- Principe n°9 : Catalyse.
L’utilisation d’agents catalytiques (aussi sélectifs que possible) est préférable à celle de procédés classiques moins sélectifs.
D’après : Paul T. Anastas et John C. Warner, Green chemistry Theory and Practice,
Oxford University Press, New York, 1998.
Utilisation atomique
Pour quantifier l’économie d’atomes, on a introduit une grandeur, l’utilisation atomique UA. Dans le contexte de cet exercice, cette grandeur est le rapport de la masse molaire du produit recherché sur la somme des masses molaires de tous les réactifs :
$$ \mathrm{ UA=\frac{ M (produit \ recherché)}{\sum \ M_i (réactif) } =\frac{ M (produit \ recherché)}{\sum \ M_j (produit) } }$$
Une valeur de UA proche de 1 met en évidence le peu de perte d’atomes en sous-produits lors de la réaction. Dans une réaction sans sous-produit UA = 1. L’objectif de cet exercice est d’étudier deux procédés de fabrication du (-)-menthol.
1. Synthèse du (-) menthol par le procédé au thymol
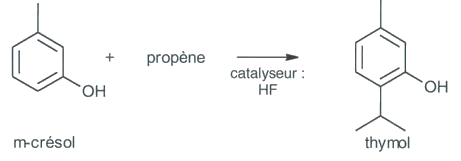
L’une des premières synthèses du (-)-menthol a été réalisée à partir du m-crésol issu des goudrons de charbon. Dans une première étape, on obtient le thymol en faisant réagir le propène sur le m-crésol, suivant la réaction :
Le thymol est ensuite hydrogéné dans une deuxième étape. Mais l’existence de plusieurs atomes de carbone asymétriques dans la molécule de menthol conduit dans cette synthèse à la formation de 8 stéréoisomères du menthol. C’est au prix de nombreuses étapes de séparation que l’on parvient à isoler le (-)-menthol.
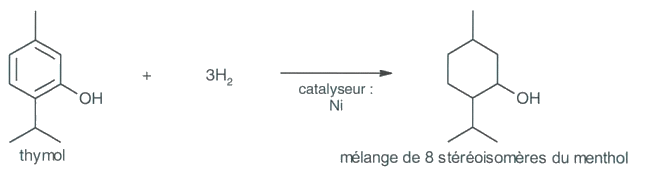
1.1. Donner les formules semi-développée et topologique du propène.
1.2. Choisir, en justifiant, le type de réaction auquel appartient la réaction d’hydrogénation du thymol dans la liste suivante : acide-base, addition, élimination, substitution.
1.3. Recopier la formule topologique du (-)-menthol et indiquer, par des astérisques, les atomes de carbone asymétriques.
1.4. Deux stéréoisomères du (-)-menthol sont représentés ci-dessous. Préciser le type de relation de stéréoisomérie qui lie le (-)-menthol avec le stéréoisomère 1 d’une part et avec le stéréoisomère 2 d’autre part. Justifier chaque type de relation.
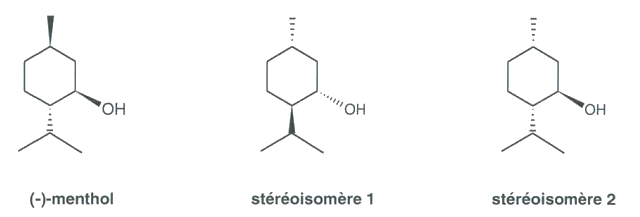
1.5. Si les deux étapes de la synthèse sont totales et si les 8 stéréoisomères du menthol sont obtenus dans les mêmes proportions, quel est le rendement de la synthèse du(-)-menthol ?
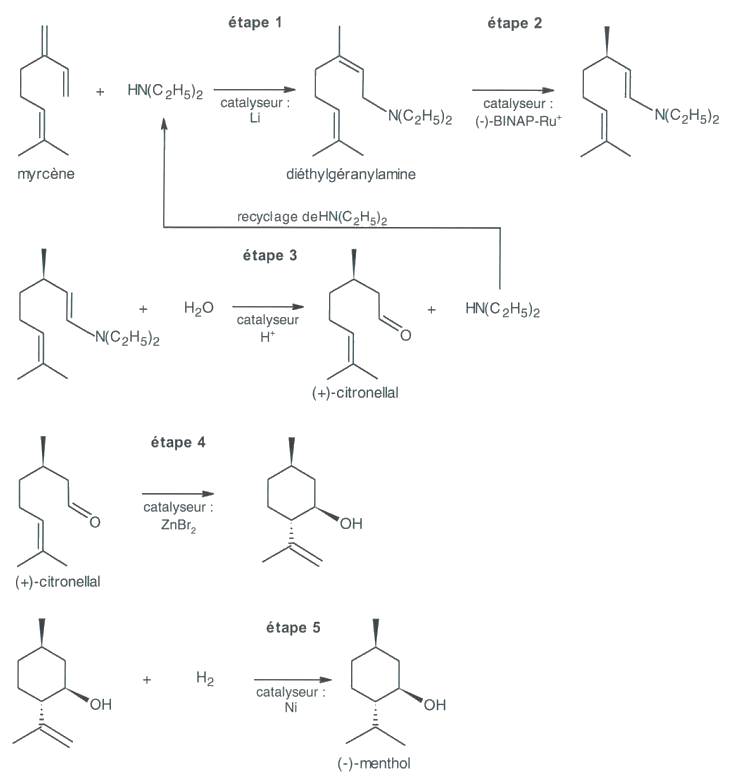
2. Synthèse du (-) menthol par le procédé Takasago développé par l’équipe de Ryoji Noyori
Cette synthèse énantiosélective, à partir du myrcène de formule brute C10H16 présent dans le pétrole raffiné, implique une catalyse asymétrique et s’effectue selon le schéma réactionnel représenté en page suivante.
2.1. Le myrcène présente-t-il une stéréoisomérie de type Z/E ? Justifier votre réponse.
2.2. Dans ce procédé, identifier les étapes créant un ou plusieurs atomes de carbone asymétriques et identifier celle impliquant une catalyse asymétrique.
2.3. Compte tenu du recyclage de la diéthylamine HN(C2H5)2, le bilan global du procédé peut s’écrire :
myrcène + X + Y → (-)-menthol
Donner les formules brutes des deux molécules X et Y présentes dans ce bilan.
3. Comparaison des deux procédés de synthèse
Présenter de façon détaillée, les points positifs du procédé Takasago par rapport au procédé au thymol dans une perspective du respect des deux principes de la chimie verte fournis. Il sera
tenu compte de la rigueur de l’argumentation.
Schéma réactionnel du procédé Takasago développé par l’équipe de Ryoji Noyori
D’après : Leffingwell, J.C. & R.E. Shackelford, Laevo-Menthol - Syntheses and organoleptic properties, Cosmetics and Perfumery.
|