|
Et si l’électricité prenait désormais sa source dans la nature grâce aux biopiles… Depuis dix ans, glucose, bactéries ou plantes inspirent les chercheurs en quête d’une source d’énergie alternative et propre. Les avancées dans ce domaine se multiplient notamment pour des applications biomédicales nécessitant de faibles puissances électriques (alimentation d’un pacemaker par exemple).
En 2010, des chercheurs ont ainsi réussi à mettre au point une pile uniquement alimentée par le glucose de l’organisme. Ce dispositif de quelques millimètres permet au dioxygène et au sucre présents dans différents liquides physiologiques du corps de réagir. Cette réaction, qui génère des électrons, conduit à la production de courant par la pile. Le procédé, totalement naturel, est basé sur l’oxydation du glucose par le dioxygène, avec l’utilisation d’enzymes qui recouvrent les électrodes.
D’après le site Le journal cnrs
Schéma du principe de fonctionnement de la biopile au glucose :
D'après Frédéric Barrière, Université de Rennes 1
Réaction d’oxydation à l’anode : C6H12O6 → C6H10O6 + 2 H++ 2 e–
Réaction de réduction à la cathode : O2 + 4 H++ 4 e– → 2 H2O
Biopile à glucose implantable dans le corps humain
Données :
- masses molaires atomiques : M(H) = 1,0 g·mol-1 ; M(C) = 12,0 g·mol-1; M(O) = 16,0 g·mol-1 ;
- électronégativité selon l’échelle de Pauling : χ(H) = 2,2 ; χ(C) = 2,6 ; χ(O) = 3,4 .
1. Le glucose
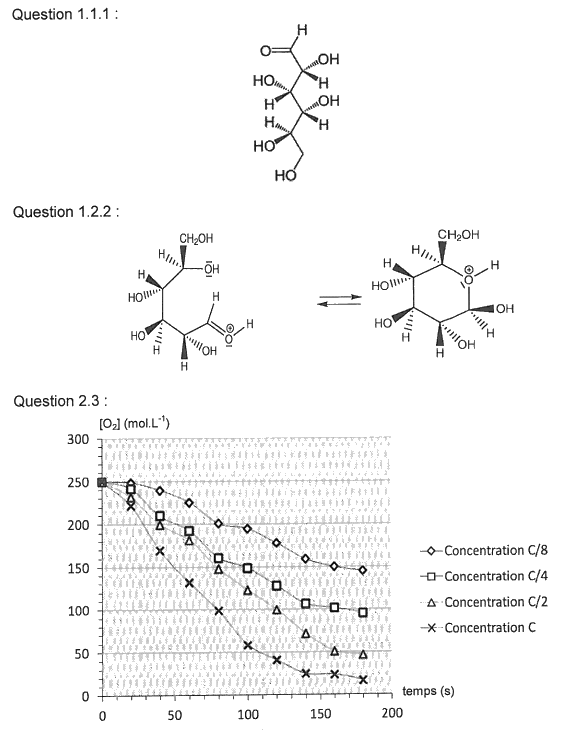
Le glucose existe dans la nature sous deux formes : une forme linéaire, le D-glucose, et deux formes cycliques : le α-D-glucopyranose et le β-D-glucopyranose.
1.1. Forme linéaire du glucose
La représentation de Cram du D-glucose est donnée ci-contre.
1.1.1. Identifier sur l’annexe à rendre avec la copie les groupes caractéristiques de cette molécule et nommer la fonction associée à chacun d’eux.
1.1.2. Sur la même représentation de la molécule de D-glucose (annexe), identifier les atomes de carbone asymétrique.
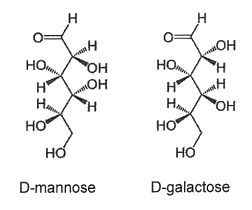
1.1.3. Deux stéréoisomères du glucose, le D-mannose et le D-galactose, existent dans la nature. Sont-ils des énantiomères du D-glucose ? Justifier.
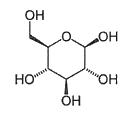
1.2. Forme cyclique du glucose
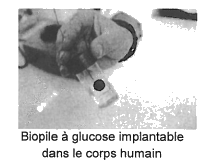
La représentation de Cram du β-D-glucopyranose est donnée ci-dessous.
Les étapes du mécanisme de cyclisation permettant de passer de la forme linéaire du D-glucose à la forme cyclique, le β-D-glucopyranose, sont données ci-après.
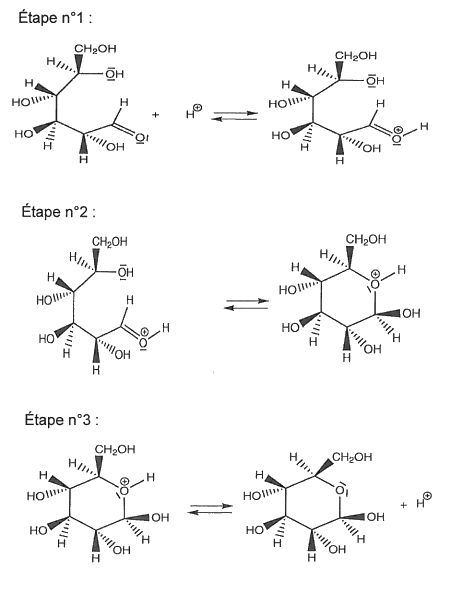
1.2.1. Sur l’annexe à rendre avec la copie, identifier le site donneur et le site accepteur mis en jeu dans l’étape n°2, et représenter les flèches courbes rendant compte de cette étape.
1.2.2. La cyclisation est d’autant plus rapide que la concentration en ion H+ est importante. Peut-on considérer que l’ion H+ est catalyseur de cette réaction ? Justifier.
2. Rôle de l’enzyme glucose oxydase dans l’oxydation du glucose
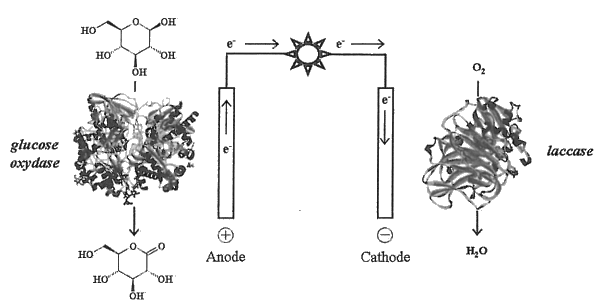
Pour illustrer les effets de l’enzyme glucose oxydase, des élèves réalisent quatre suivis cinétiques de l’oxydation du glucose par le dioxygène. Ils réalisent quatre mélanges identiques de solution de glucose et de dioxygène, le dioxygène étant le réactif limitant. Dans chaque mélange, l’enzyme est introduite avec des concentrations différentes : \(\displaystyle\mathrm { c_1=c }\) , \(\displaystyle\mathrm { c_2=\frac{c}{2} }\) , \(\displaystyle\mathrm { c_3=\frac{c}{4} }\) , \(\displaystyle\mathrm { c_4=\frac{c}{8} }\) où c est une concentration de référence en enzyme. Les courbes donnant la concentration en dioxygène dans le milieu en fonction du temps pour chaque expérience sont représentées ci-après.
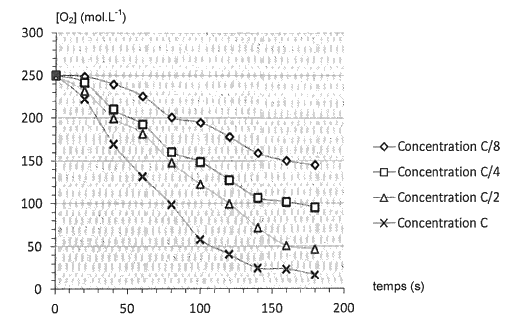
Cinétique enzymatique et concentration en enzyme (glucose oxydase)
(d’après le site académique d’Orléans-Tours)
2.1. Écrire l’équation de la réaction d’oxydation du glucose par le dioxygène, sachant que les couples oxydant/réducteur mis en jeu sont C6H10O6/C6H12O6 et O2/H2O.
2.2. Quel est le rôle de la glucose oxydase dans la réaction d’oxydation du glucose par le dioxygène ? Justifier.
2.3. Représenter qualitativement, sur l’annexe à rendre avec la copie, l’allure de la courbe donnant l’évolution de la concentration en dioxygène dans la solution en l’absence de glucose oxydase.
2.4. Comment évolue le temps de demi-réaction en fonction de la concentration en enzyme ? Justifier graphiquement sur l'annexe à rendre avec la copie.
2.5. Dans la biopile au glucose, l’oxydation du glucose a lieu à l’anode et la réduction du dioxygène, à la cathode. L’intensité du courant étant d’autant plus grande que le débit d’électrons dans le circuit est important, que peut-on dire de l’évolution de l’intensité du courant en fonction de la concentration en glucose oxydase ?
2.6. En réalité, l’enzyme est opérante uniquement sous la forme cyclique principale du glucose, le β-D-glucopyranose, et inopérante sous la forme linéaire du glucose ou sur l’autre forme cyclique du glucose, le α-D-glucopyranose. Quelle caractéristique de sa réactivité cela illustre-t-il ?
3. Durée de fonctionnement de biopiles
L’obstacle majeur d’un développement à large échelle des biopiles reste leurs dimensions. Pour alimenter de gros appareils, il faut en effet en associer un grand nombre. À titre d’exemple, l’entreprise Sony a commercialisé un lecteur mp3 nécessitant une puissance d’alimentation égale à 150 mW alimenté par une pile composée de sucre et d’eau. La pile avait une longueur d’environ 20 cm (voir photo ci-contre) et une réserve de 100 g de glucose.
Données :
- énergie libérée par la réaction du glucose et du dioxygène dans la biopile : 150 kJ par mole de glucose oxydé ;
- énergie E (en joule) reçue par le lecteur mp3 pendant la durée ∆t (en seconde) : E=P ∆t où P (en watt) est la puissance d’alimentation.
3.1. Déterminer la durée de fonctionnement du lecteur mp3 alimenté par la biopile au glucose commercialisée.

Sony.net
3.2. On trouve du glucose dans les fruits, ce qui fait des jus de fruits un moyen de recharger les biopiles. L’étude qui suit a pour objectif d’évaluer l’énergie disponible dans une biopile au glucose rechargée avec un litre de jus de raisin.
On introduit dans une fiole jaugée de 50 mL, 2,0 mL de jus de raisin et 20,0 mL d’une solution de diiode (coloration jaune en milieux aqueux) de concentration 2,0·10–2 mol·L-1. La fiole est complétée par une solution d’hydroxyde de sodium. La réaction qui se produit lors du mélange a pour équation chimique :
I2(aq) + 3 HO–(aq) + RCHO(aq) → RCOO–(aq) + 2 H2O + 2 I–(aq)
Les ions hydroxyde et le diiode sont introduits en excès. Le glucose est noté RCHO. Une fois la réaction terminée le diiode en excès est dosé par spectrophotométrie, l’appareil est réglé à la longueur d’onde de 440 nm : la mesure de l’absorbance d’un échantillon de la solution donne A = 1,6.
Une courbe d’étalonnage a été tracée à cette longueur d’onde à partir de quatre solutions de concentration connue en diiode.

Déterminer la durée de fonctionnement du mp3, alimenté par une pile au glucose composée d’un litre de ce jus de raisin.
Le candidat est invité à présenter la démarche suivie, même si elle n’a pas abouti. Toute prise d’initiative sera valorisée.
|