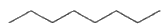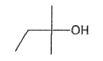|
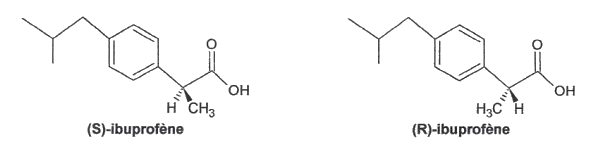
L'ibuprofène® est un anti-inflammatoire non stéroïdien. Il possède des propriétés antalgiques, antipyrétiques, anti-inflammatoires. On vend sous l'appellation ibuprofène® un produit de synthèse, correspondant au mélange équimolaire de (S)-ibuprofène et de (R)-ibuprofène, ces deux molécules étant énantiomères; ce mélange est donc qualifié de racémique. Or seul le (S)-ibuprofène est responsable de l'effet clinique (160 fois plus efficace que le (R)-ibuprofène in vitro). De plus, pris seul, le (S)-ibuprofène agit plus rapidement et diminue les effets secondaires par rapport à la prise du mélange racémique. Vendre dorénavant des médicaments énantiomériquement purs, plutôt que des mélanges racémiques, est une tendance forte de l'industrie pharmaceutique.
Le but de cet exercice est d'analyser une méthode permettant de réaliser la séparation du (S)-ibuprofène du (R)-ibuprofène. La qualité de cette séparation est évaluée à l'aide d'une grandeur appelée excès énantiomérique .
L'excès énantiomérique
Soit un mélange contenant deux énantiomères notés R et S. L'excès énantiomérique du mélange, noté ee et exprimé en %, est donné par la relation :
$$\mathrm{ ee= \left| \frac{n_R-n_S}{n_R+n_S} \right| \times 100 } $$
où nr et ns sont respectivement les quantités de matière des énantiomères R et S.
1. Mélange racémique présent dans l'ibuprofène®
1.1. Justifier que les molécules (S)-ibuprofène et (R)-ibuprofène sont des énantiomères.
1.2. Indiquer la valeur de l'excès énantiomérique ee de l'ibuprofène®.
1.3. Quelle devrait être la valeur de l'excès énantiomérique ee pour un médicament énantiomériquement pur ?
1.4. Citer deux techniques de séparation classiques en chimie. Indiquer pour quelles raisons ces techniques ne permettent pas de séparer le (S)-ibuprofène du (R)-ibuprofène d'un mélange.
2. Étude d'une stratégie de séparation du (S)-ibuprofène et du (R)-ibuprofène
Réaction d'estérification de l'ibuprofène
Les deux énantiomères de l'ibuprofène peuvent réagir avec un alcool R-OH pour donner un ester et de l'eau. Cette réaction chimique, appelée réaction d'estérification, est extrêmement lente et limitée à température ambiante.
La présence dans le mélange réactionnel d'une enzyme, la Candida Rugosa Lipase, notée CRL7, permet de diminuer la durée de la réaction d'estérification du (S)-ibuprofène seulement. l'équation de la réaction d'estérification est la suivante :
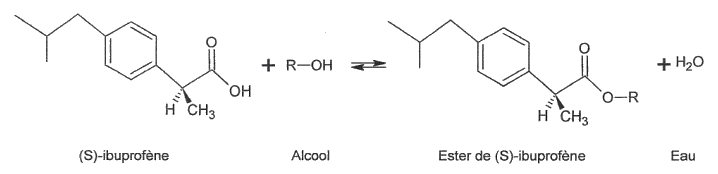
L'estérification du (R)-ibuprofène reste très lente, au point que l'on peut considérer qu'il ne se forme pas d'ester du (R)-ibuprofène, même au bout de 12 h. Pour séparer les deux énantiomères, on met en œuvre le protocole décrit ci-après :
Protocole de séparation des énantiomères de l'ibuprofène
Étape 1 : on laisse réagir pendant 12 h et sous agitation un mélange réactionnel contenant
- 5,0 ml de solvant;
- 0,100 mmol d'ibuprofène® ;
- 1,00 mmol d'alcool;
- 0,1 g de CRL7 introduit à l'instant t = 0.
Étape 2 : au bout de 12 h, on réalise une analyse du mélange réactionnel par une technique adaptée afin de déterminer la quantité de matière de (R)-ibuprofène et celle de (S)-ibuprofène restantes dans le mélange réactionnel.
Étape 3 : la quantité d'ester de (S)-ibuprofène produite après 12 h de réaction est extraite du mélange réactionnel par distillation.
Étape 4: l'ester de (S)-ibuprofène récupéré est transformé intégralement en (S)-ibuprofène par hydrolyse, réaction inverse de l'estérification.
2.1. Recopier la formule du (S)-ibuprofène, entourer le(s) groupe(s) caractéristique(s) présent(s) et nommer la(es) famille(s) chimique(s) correspondante(s).
2.2. Y a-t-il lors de la réaction d'estérification précédente, modification de chaîne ou de groupe caractéristique ? Justifier.
2.3. Pourquoi l'enzyme CRL7 n'apparaît-elle pas dans l'équation de la réaction d'estérification?
Le protocole de séparation est réalisé à une température θ= 50°C, en utilisant pour alcool le méthanol et pour solvant l'isooctane. L'analyse réalisée lors de l'étape 2 indique qu'au bout de 12 h, le mélange réactionnel contient le (R)-ibuprofène et 0,012 mmol de (S)-ibuprofène.
2.4. Dans ces conditions, calculer la valeur de l'excès énantiomérique ee du mélange réactionnel à l'instant t=12h.
2.5. Déterminer la quantité de matière de (S)-ibuprofène qu'on peut récupérer par hydrolyse de l'ester de (S)-ibuprofène extrait à l'étape 3 ?
2.6. Quelle serait la valeur de l'excès énantiomérique ee du mélange réactionnel si la réaction d'estérification était totale?
3. Optimisation des conditions expérimentales de séparation des énantiomères de l'ibuprofène
Afin d'améliorer la séparation des énantiomères de l'ibuprofène, une équipe de chercheurs a étudié l'influence de différents paramètres sur la réaction d'estérification de l'ibuprofène du protocole de séparation. Ces résultats sont présentés ci-après.
Influence des conditions expérimentales de l'estérification sur l'excès énantiomérique ee
Pour chacune des expériences de l'équipe de chercheurs, la réaction d'estérification de l'ibuprofène a été réalisée à une température θ en utilisant 5,0 ml de solvant, 0,100 mmol d'un mélange racémique d'ibuprofène, une quantité de matière notée n d'alcool et 100 mg de CRL7. L'excès énantiomérique ee est mesuré au bout de 12 h. Les résultats des différentes séries de mesures de l'excès énantiomérique ee réalisées sont donnés ci-après.
Série de mesures n°1 : Mesures réalisées pour θ=50°C, n= 1,00 mmol de 2-éthyIhexan-1-ol.
| Solvants organiques utilisé | Formule brute | Formule topologique | ee (%) |
| Hexane | C6H14 |  | 43 |
| Octane | C8H18 | 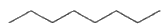 | 44 |
Isooctane
(2,2,4-triméthylpentane) | C8H18 | | 94 |
Série de mesures n°2 : Mesures réalisées pour θ=50°C, n= 1,00 mmol d'acool et le solvant isooctane.
| Alcool R-OH usuels | Formule brute | Masse volumique
(en g·mL-1) | Formule topologique | ee (%) |
| Pentan-1-ol | C5H12O | 0,814 |  | 65 |
| Isoamylol | C5H12O | 0,815 |  | 88 |
Isooctanol
2-éthylhexan-1-ol | C8H18O | 0,832 | 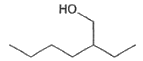 | 94 |
Tert-amyl alcool
2-méthylbutan-2-ol | C5H12O | 0,810 | 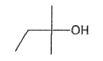 | 0 |
Série de mesures n°3 : Mesures réalisées pour θ= 50°C en utilisant le 2-éthylhexan-1-ol et le solvant isooctane.
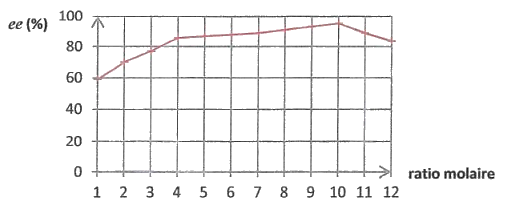
Excès énantiomérique ee en fonction du ratio molaire
Le ratio molaire est le rapport entre les quantités de matière initiales d'alcool et d'ibuprofène.
Série de mesures n°4 : Mesures réalisées en utilisant n = 1,00 mmol de 2-éthylhexan-1-ol et le solvant isooctane.
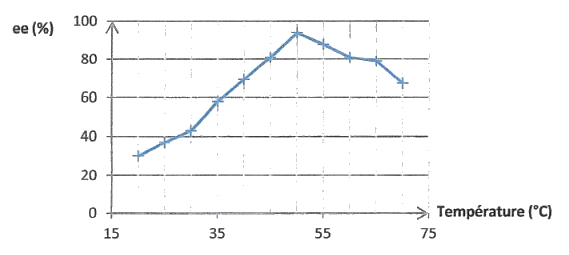
Excès énantiomérique ee en fonction de la température
D'après The Scienfific World Journal, volume 2013, article ID 364730.
Données :
Un alcool R - OH est dit :
- alcool primaire si le carbone portant le groupement hydroxyle n'est lié qu'à un unique autre atome de carbone ;
- alcool secondaire si le carbone portant le groupement hydroxyle est lié à deux autres atomes de carbone;
- alcool tertiaire si le carbone portant le groupement hydroxyle est lié à trois autres atomes de carbone.
Masses molaires atomiques en g·mol-1: M(H) = 1,0; M(C) = 12,0; M(O) = 16,0.
3.1. Donner la formule topologique de l'isooctane et le nom de l'isoamylol en nomenclature officielle.
3.2. Pour chaque série de mesures, formuler une hypothèse que la série permet de tester.
3.3. Quelle classe d'alcool semble être à exclure pour réaliser la séparation des énantiomères de l'ibuprofène ? Comment pourrait-on conforter ce résultat ? On admettra que l'ester de (S)-ibuprofène peut toujours être séparé du mélange réactionnel.
3.4. À partir des résultats de l'équipe de chercheurs, préciser quelles pourraient être les conditions expérimentales les plus favorables pour séparer les énantiomères de l'ibuprofène selon le protocole de séparation.
3.5. Quel volume de l'alcool choisi à la question 3.4. faut-il prélever pour réaliser la séparation des énantiomères de l'ibuprofène dans les conditions du protocole qui a été précisé?
|