|
Dans le modèle théorique, on considère que la puissance totale Ptot développée par le cycliste, lors de la montée, va permettre de :
- vaincre les forces de pesanteur pour permettre l’ascension (Pasc) ;
- lutter contre les frottements mécaniques des roues sur le bitume (Proulement) ;
- contrer les frottements de l’air (Pair).
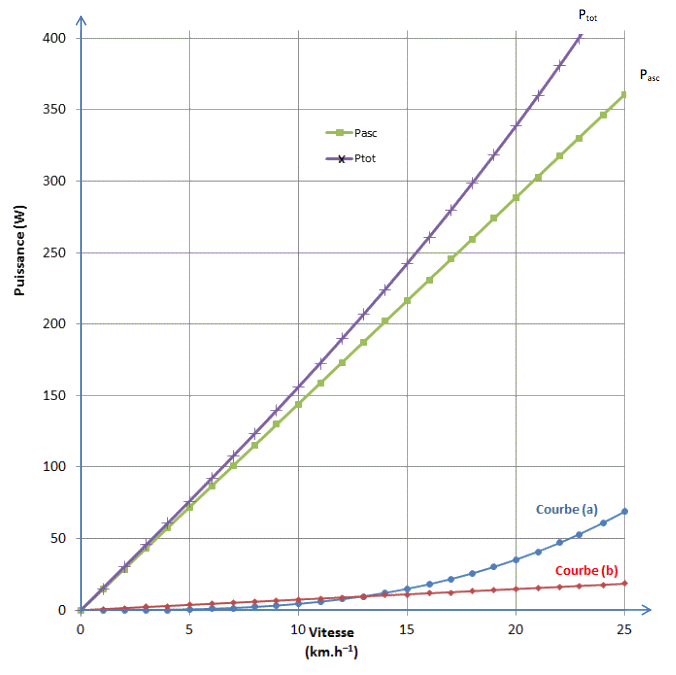
Dans ce modèle, les puissances Pasc et Proulement sont proportionnelles à la vitesse du cycliste alors que Pair est proportionnelle au cube de cette vitesse. Le modèle théorique utilisé permet de construire le graphique suivant qui donne les valeurs des différentes puissances en fonction de la valeur de la vitesse lors de l’ascension du col.
Graphique 1 : Modélisation des différentes puissances développées par le cycliste en fonction de sa vitesse dans les conditions de la montée du col (les courbes (a) et (b) seront identifiées dans le cadre de l’exercice)
Données :
- Intensité de la pesanteur g = 9,8 m·s–2.
- Pour une puissance constante sur la durée considérée, la variation d’énergie ΔE s’exprime par : ΔE = P·Δt , avec ΔE en joule, Δt en seconde et P en watt.
On étudie le système S {cycliste, équipement, vélo} de masse m 67,8 kg. On suppose que l’ascension se fait à vitesse v constante et à puissance Ptot constante.
1. Questions préliminaires
1.1. Dans quel référentiel sont effectuées les mesures ?
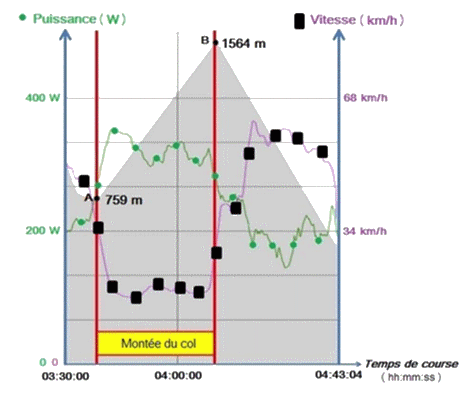
1.2. Montrer, sans utiliser le document 1, que la vitesse moyenne du cycliste, lors de l’ascension, vaut v = 19,6 km·h–1 .
1.3. Définir l’énergie mécanique Em d’un système. Que peut-on dire alors de l’évolution de cette énergie lors de l’ascension ?
2. Étude de l’ascension du col par le cycliste et validation du modèle de calcul de puissances
On cherche à valider le modèle proposé en utilisant les données du capteur SRM lors de l’ascension du col par le cycliste.
2.1. Donner l’expression littérale de la variation d’énergie potentielle de pesanteur Epp du système entre le pied et le sommet du col de la Hourquette d’Ancizan, en fonction de m, g et de ZA et ZB, (respectivement altitudes du pied et du sommet du col). Montrer que Epp = 5,3·105 J.
2.2. À partir du résultat de la question 2.1, calculer la valeur de Pasc et vérifier sur le graphique 1 qu’elle correspond bien à celle du modèle proposé.
2.3. Parmi les courbes (a) et (b) du graphique 1, identifier, en explicitant votre raisonnement, celle qui représente Proulement et celle qui représente Pair. En déduire les valeurs de Proulement et Pair, lors de l’ascension du col par le cycliste.
2.4. En utilisant le graphique 1, déterminer la puissance totale Ptot prédite par le modèle lors de l’ascension. Les mesures réalisées par le capteur SRM, placé sur le pédalier du cycliste, permettent-elles de valider le modèle ?
3. Prédiction de performances à partir du modèle
Un cycliste amateur développe une puissance totale constante Ptot = 250 W lors de la montée. En utilisant le modèle étudié, donner une estimation de la durée de l’ascension du col par le cycliste.
Partie 2 : Étude de la physiologie de l’effort et régulation du pH sanguin
Lors des efforts physiques, des mécanismes biologiques ont pour conséquence la production d’acide lactique par l’organisme. Cet acide a été identifié comme responsable, puis témoin de la fatigue et il est aujourd’hui un indicateur de plus en plus utilisé pour évaluer l’impact d’un entrainement. En effet, pendant un exercice, la concentration en ions lactate dans le sang augmente. Dès 1930, Owles définit un niveau métabolique critique, appelé « seuil lactique », par l’intensité d’exercice au-dessus de laquelle le taux de lactate dans le sang s’accroît rapidement alors que le taux de bicarbonate plasmique baisse.
D’après Volodalen
Dans cette partie, on étudie les mécanismes de régulation qui interviennent lors de l’acidification de l’organisme au cours de la pratique d’un sport d’endurance comme le cyclisme.
pH et tampons dans l’organisme
Comme les protons sont en partie captés par les divers tampons cellulaires (composés phosphatés, protéines, acides aminés…) et sanguins (protéines plasmatiques, hémoglobine, bicarbonate…), le pH ne varie que très peu dans les cellules et dans le sang malgré de fortes sollicitations de la glycogénolyse. La glycogénolyse est le processus par lequel le glycogène présent dans le foie est transformé en glucose à destination du sang.
D’après Cazorla, Petibois, Bosquet, Léger ; Lactate et exercices : mythes et réalités, STAPS
Données : Valeurs normales dans le sang, à 37 °C et en l’absence d’efforts
- pH sanguin = 7,4 (limites compatibles avec la vie : 7,0 à 7,8 unités de pH) ;
- le pH intramusculaire varie entre 7,1 et 6,1 ;
- concentration en ions hydrogénocarbonate (aussi appelés ions bicarbonate) : [HCO3-]0= 25 mmol·L–1;
- le CO2 dissous dans le sang est sous la forme H2CO3(aq) ;
- concentration en CO2 dissous dans le sang : [H2CO3]0 = 0,9 mmol·L–1.
1. L’acide lactique
L’acide lactique, dont la formule est donnée ci-dessous, est formé dans l’organisme à partir de l’acide pyruvique selon une réaction d’oxydoréduction catalysée par la LDH (lactate déshydrogénase).
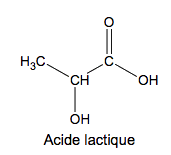
1.1. Déterminer les groupes caractéristiques présents dans l’acide lactique et associer à chacun d’eux la famille chimique correspondante.
1.2. En utilisant la représentation de CRAM, donner les différents stéréoisomères de configuration de l’acide lactique en précisant la relation de stéréoisomérie qui existe entre eux.
2. Influence de la production d’acide lactique sur le pH sanguin
Le « seuil lactique », facteur déterminant de la performance en course longue telle que la course cycliste, est utilisé dans le suivi des cyclistes. Il correspond à la concentration en ions lactate à ne pas dépasser pour optimiser les performances et limiter la fatigue. On fixera la valeur de ce « seuil lactique » à 3,0 mmol·L–1.
On s’intéresse à la formation d’acide lactique par l’organisme, en l’absence de régulation de pH.
2.1. L’ion lactate est la base conjuguée de l’acide lactique. Représenter la formule semi-développée de l’ion lactate en faisant apparaître les doublets libres. Pour la suite de l’exercice on notera AH l’acide lactique et A– l’ion lactate.
2.2. Écrire l’équation de la réaction chimique entre l’acide lactique et l’eau (réaction 1).
2.3. Comparer les quantités de matière en ions oxonium H3O+(aq) et en ions lactate produites lors de la réaction 1.
2.4. En déduire quel serait le pH du sang quand le « seuil lactique » est atteint, lors d’un effort, en absence de régulation. En déduire si une régulation du pH sanguin est nécessaire.
3. Régulation du pH sanguin
On s’intéresse à la régulation par le système « tampon bicarbonate » faisant intervenir le couple H2CO3(aq) / HCO3-. On raisonnera en l’absence de toute autre réaction acido-basique.
3.1. Écrire l’équation de la réaction entre l’acide lactique et les ions hydrogénocarbonate, réaction considérée comme totale (réaction 2). Expliquer alors la phrase : « le taux de lactate dans le sang s’accroît alors que le taux de bicarbonate plasmique baisse ».
3.2. Montrer que lorsqu’on atteint le « seuil lactique », et si seule la réaction (2) contribue à former du H2CO3, la valeur de la concentration de H2CO3 à l’état final a augmenté par rapport à sa valeur normale et vaut [H2CO3]f = 3,9 mmol·L–1.
3.3. Si on ne considère que cette réaction (2), le pH du sang peut être calculé grâce à l’équation de Henderson-Hasselbalch :
$$\mathrm{ pH= 6,1 + \frac{[HCO_3^-]_f}{[H_2CO_3]_f} } $$
Montrer que pH= 5,6 à l’atteinte du seuil lactique. Cette régulation du pH sanguin est-elle efficace ?
3.4. Expliquer pourquoi d’autres systèmes tampons jouent forcément un rôle dans la régulation du pH de l’organisme.
3.5. Les poumons interviennent en second lieu, après la régulation par les systèmes tampons. Expliquer quel peut être leur rôle.
|