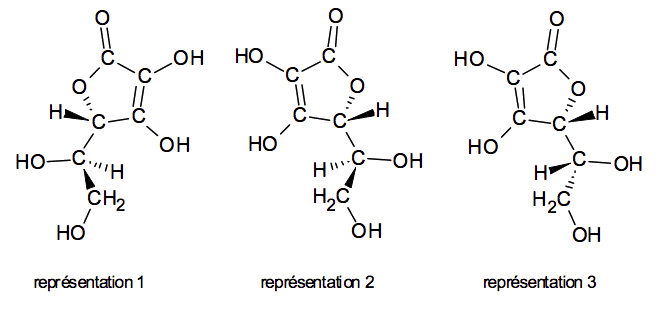|
La vitamine C est une espèce chimique hydrosoluble, dotée de propriétés antioxydantes. L’organisme humain la puise dans les aliments tels que les fruits et légumes. Une carence prolongée provoque des pathologies qui conduisent le médecin à prescrire un complément sous forme de comprimés.
Dans cet exercice, on étudie la molécule de vitamine C dans une première partie, puis on vérifie l’indication apposée sur l’emballage d’une boîte de comprimés de vitamine C dans le cadre d’un contrôle.
Extrait de l’emballage de la boîte de comprimés de vitamine C :
La vitamine C est commercialisée sous forme de comprimés à croquer.
Composition d’un comprimé de « Vitamine C UPSA® » :
• Acide ascorbique : 250 mg
• Ascorbate de sodium : 285 mg
• Excipients : sucres, arômes artificiels
Données :
- L’acide ascorbique, de formule brute C6H8O6 sera noté HA et sa base conjuguée A ;
- pKA(HA/A)= 4,1 à 37 °C ;
- Masse molaire de l’acide ascorbique M = 176,1 g·mol-1 ;
- Masse molaire de l’ascorbate de sodium M = 198,1 g·mol-1 ;
- Conductivités molaires ioniques à 25° C : λ(Na+)= 5,01 mS·m²·mol-1 ; λ(HO-)= 19,9 mS·m²·mol-1 ; λ(A-)= 3,42 mS·m²·mol-1 ;
- pH de l’estomac environ égal à 1,5 ;
- pH de la salive compris entre 5,5 et 6,1.
1. Étude de la molécule de l'acide ascorbique
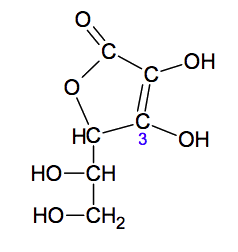
La molécule d’acide ascorbique est représentée ci-dessous :

1.1. Nommer les familles associées aux groupes caractéristiques (a) et (b) entourés sur la représentation de la molécule d’acide ascorbique.
1.2. La molécule d’acide ascorbique possède des stéréoisomères.
1.2.1. Recopier la formule de la molécule puis repérer le ou les atomes de carbone asymétriques par un astérisque en justifiant votre choix.
1.2.2. Trois stéréoisomères de la molécule d’acide ascorbique sont représentés ci-dessous. Reconnaître si ces représentations sont identiques, énantiomères ou diastéréoisomères.
1.3. Les propriétés acido-basiques de cette molécule sont dues à l'hydrogène porté par l’oxygène du groupe caractéristique associé à l’atome de carbone en position 3.
Représenter l’ion ascorbate, base conjuguée de l’acide ascorbique.
1.4. Sous quelle forme la substance active ingérée lors de la prise du comprimé de vitamine C se trouve-t-elle sur la langue ? Dans l’estomac ? Justifier par une méthode de votre choix.
2. Vérification de la masse d’acide ascorbique dans un comprimé
On souhaite vérifier l’indication portée sur la boîte concernant la masse d’acide ascorbique présente dans un comprimé, à l’aide d’un titrage acidobasique suivi par conductimétrie. Une solution aqueuse SA de volume V = 200,0 mL est préparée à partir d’un comprimé entier.
On prélève un volume VA = (20,0 ± 0,1) mL de la solution aqueuse SA que l’on titre par une solution aqueuse d’hydroxyde de sodium (Na+(aq) + HO-(aq) ).
2.1. Rédiger le protocole de préparation de la solution aqueuse SA.
2.2. Écrire l’équation de la réaction support du titrage.
2.3. Au laboratoire, on dispose d’une solution aqueuse étalonnée d’hydroxyde de sodium de concentration molaire CB = 0,100 mol·L-1. On souhaite obtenir un volume VE à l’équivalence proche de 10 mL. La solution aqueuse d’hydroxyde de sodium disponible au laboratoire convient-elle ? Si non, que peut-on faire pour obtenir l’ordre de grandeur du volume à l’équivalence souhaité ?
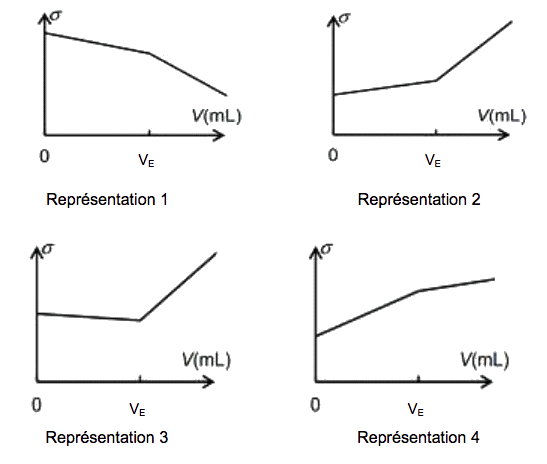
2.4. Parmi les quatre graphiques suivants, lequel représente l'allure de l'évolution de la conductivité σ du mélange en fonction du volume V de solution d’hydroxyde de sodium versé lors de ce titrage ? Justifier.
2.5. Avec une solution aqueuse d’hydroxyde de sodium (Na+(aq) + HO-(aq) ) de concentration molaire CB = (1,50 ± 0,02)·10–2 mol·L-1, le volume versé à l’équivalence vaut (9,1 ± 0,2) mL. On en déduit que la masse expérimentale d’acide ascorbique du comprimé est égale à 245 mg.
2.5.1. Déterminer l’incertitude relative \(\displaystyle\mathrm{ \frac{U_{m_{exp}}}{m_{exp}} } \) dont on admet que, dans les conditions de l’expérience, la valeur est donnée par la relation : \(\displaystyle\mathrm{ \left( \frac{U_{m_{exp}}}{m_{exp}} \right)^2 = \left( \frac{U_{V_{E}}}{V_{E}} \right)^2 +\left( \frac{U_{C_{B}}}{C_{B}} \right)^2 } \)
2.5.2. Le résultat expérimental est-il en accord avec la mention portée sur la boîte de comprimés de vitamine C ? Interpréter l’écart éventuellement obtenu.
3. Vérification de la masse d’ion ascorbate dans un comprimé
3.1. Pour vérifier par titrage la masse d’ascorbate de sodium contenue dans un comprimé, que faut-il choisir comme réactif titrant ?
A- une solution aqueuse d’hydroxyde de sodium (Na+(aq) + HO-(aq) );
B- une solution aqueuse d’acide chlorhydrique (H3O+(aq) + Cl(aq));
C- une solution aqueuse de chlorure de sodium (Na+(aq) + Cl(aq)).
Choisir la ou les propositions exactes en justifiant votre choix.
3.2. La masse d’ascorbate de sodium trouvée après titrage correspond à celle indiquée sur l’emballage. L’étiquette précise également que la masse totale des deux espèces conjuguées est équivalente à 500 mg d’acide ascorbique. Vérifier cette information par un calcul.
3.3. Quel intérêt présente cette formulation du comprimé de vitamine C par rapport à un comprimé qui contiendrait uniquement 500 mg d’acide ascorbique ?
|