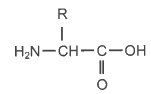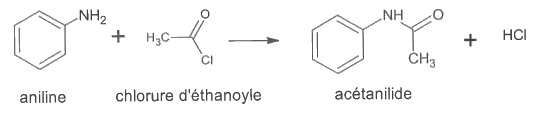|

Les protéines, assemblage tridimensionnel d'acides aminés, sont omniprésentes dans notre organisme. Elles assurent une multitude de fonctions biologiques. La synthèse de ces macromolécules est réalisée « in vivo » (dans l'organisme) mais aussi « in vitro » (au laboratoire). Dans le corps humain, vingt acides aminés différents participent à l'élaboration des protéines. Parmi eux, on trouve la tyrosine. La tyrosine est présente dans de nombreux aliments (amande, avocat, banane, graine de citrouille, fève de Lima, etc.). Elle peut être consommée en compléments alimentaires sous forme de gélules (photo cicontre) pour lutter contre le stress et l'anxiété.
La formule topologique de la tyrosine, de masse molaire 181,0 g·mol-1 , est donnée ci-dessous :
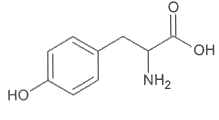
1. Étude de la molécule de tyrosine
1.1. Recopier la formule de la molécule de tyrosine. Entourer les groupes caractéristiques présents. Justifier la famille de composés à laquelle elle appartient.
1.2. La L-tyrosine est un stéréoisomère de la tyrosine. Justifier que la molécule de tyrosine possède des stéréoisomères.
1.3. En utilisant la formule simplifiée de la tyrosine représentée ci-dessous, donner en représentation de Cram les stéréoisomères de la tyrosine.
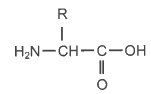
2. Étude de la première étape de la synthèse de la L- tyrosine au laboratoire
L'équation de la réaction de la première étape de la synthèse de la L-Tyrosine est la suivante :
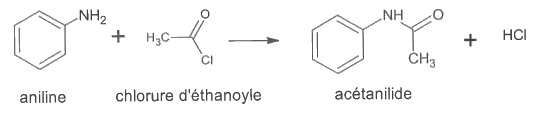
On réalise cette première étape au laboratoire en faisant réagir 10,0 mL d'aniline avec un excès de chlorure d'éthanoyle.
La masse d'acétanilide obtenue est alors de 11,2 g.
Données :
- Données physicochimiques :
| Espèce chimique | Aniline | Chlorure d'éthanoyle | Acétanilide |
| Masse molaire (g·mol-1) | 93,0 | 78,5 | 135,0 |
| Température d'ébullition (°C) | 184 | 51 | 304 |
| Température de fusion (°C) | - 6 | - 112 | 114 |
- Masse volumique de l'aniline : ρ = 1,02 g·mL-1
- Électronégativité de quelques éléments :
| Élément chimique | N | H | C | O | Cl |
| Électronégativité | 3,0 | 2,2 | 2,6 | 3,4 | 3,2 |
- Table des données IR :
| Liaison | σ (cm-1) | Intensité |
| O–H alcool libre | 3580-3670 | Forte ; large |
| N–H amine primaire (R–NH2) | 3100-3500 | 2 bandes moyennes ; fines |
| N–H amide | 3100-3500 | Moyenne ; fine |
| C=O ester | 1700-1740 | Forte ; fine |
| C=O acide | 1680-1710 | Forte ; fine |
| C=O amide | 1650-1700 | Forte ; fine |
| N–H amine primaire | 1610-1630 | Forte ; fine |
2.1. Aspect macroscopique de la première étape de la synthèse
2.1.1. Indiquer la catégorie de la réaction correspondant à la première étape de la synthèse de la L-tyrosine.
2.1.2. À partir de l'état physique des espèces mises en jeu dans la réaction, proposer une méthode expérimentale pour récupérer l'acétanilide du milieu réactionnel.
2.1.3. À l'issue de la première étape, on réalise les spectres IR de l'aniline et du produit obtenu. Montrer que l'aniline a bien été transformée intégralement en acétanilide.
Spectre IR de l’aniline
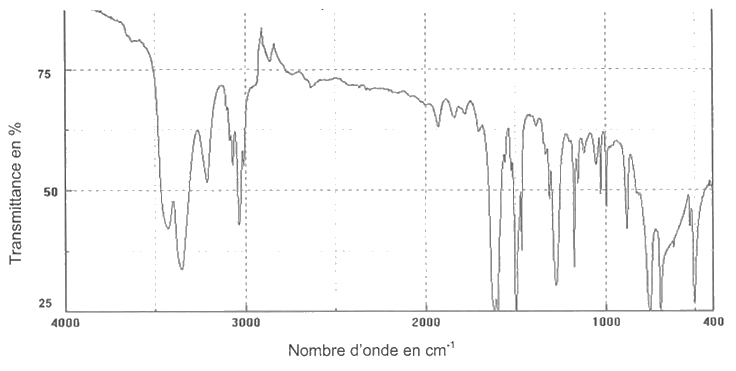
Spectre IR du produit obtenu à l'issue de la première étape
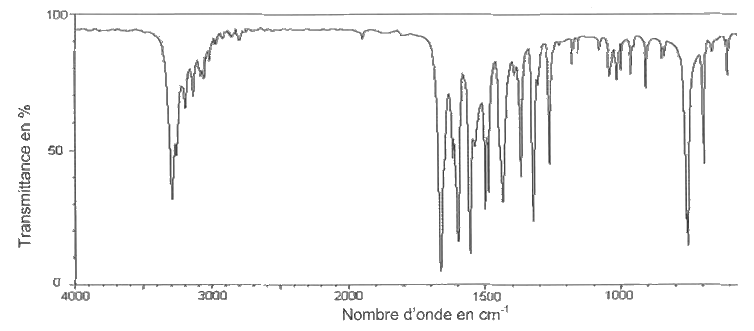
2.1.4. Montrer que le rendement de cette première étape, noté r, est de l'ordre de 75 %. Proposer une explication expérimentale pour rendre compte d'une valeur de rendement inférieure à 100 %.
2.2. Aspect microscopique de la première étape de la synthèse
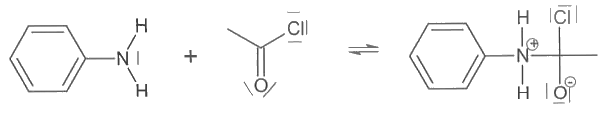
2.2.1. Sur la 1ère étape du mécanisme réactionnel de la synthèse proposé sur le document réponse 1, en annexe à rendre avec la copie, repérer en les entourant le site donneur et le site accepteur de doublets d'électrons qui interviennent dans cette étape.
2.2.2. Compléter cette étape par des flèches courbes. Qu'indiquent ces flèches ?
3. Contrôle de qualité d'une gélule de L-tyrosine
L’étiquette mentionne des gélules de L-tyrosine contenant 500 mg de principe actif. On désire vérifier cette information par un dosage spectrophotométrique.
Protocole expérimental suivi :
- Dissoudre totalement une gélule de L-tyrosine dans un volume de 2,00 L d’eau. La solution obtenue est notée S.
- Préparer une solution aqueuse de L-tyrosine de concentration c0 = 2,5·10–3 mol·L-1 à partir d’un flacon de produit pur du laboratoire. Cette solution est notée S0.
- À partir de la solution mère S0, préparer quatre solutions filles dont les concentrations sont fournies dans le tableau suivant :
| Solution fille | S1 | S2 | S3 | S4 |
| c (mol·L-1) | 5,0·10–4 | 1,0·10–3 | 1,5·10–3 | 2,0·10–3 |
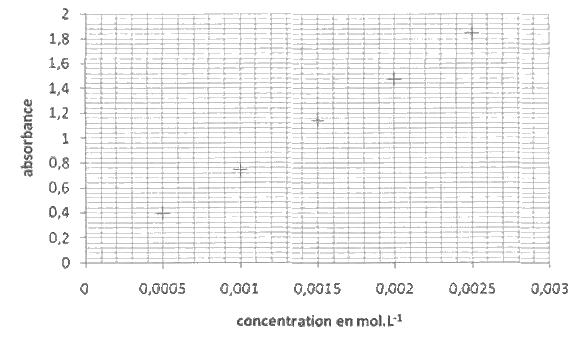
- Mesurer l’absorbance de chaque solution et tracer A = f(c).
- Mesurer l’absorbance de la solution S.
Résultats expérimentaux :
La courbe d’étalonnage obtenue est représentée sur le document réponse, en annexe à rendre avec la copie. La mesure de l’absorbance de la solution S est A = 1,0 Transmittance en %.
Donnée : spectre d’absorption UV visible d’une solution aqueuse de L-tyrosine à pH = 7
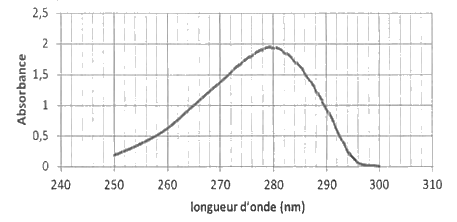
Aucune absorbance n'est observée dans un autre domaine de longueur d'onde.
3.1. Quels réglages faut-il effectuer sur le spectrophotomètre pour réaliser le contrôle qualité?
3.2. Déterminer le volume de solution mère à prélever pour préparer 100,0 mL de solution S1. Nommer la verrerie utilisée pour préparer cette solution.
3.3. La teneur en L-tyrosine de la gélule est-elle conforme à l'indication de l'étiquette du médicament ? Tout élément de la démarche sera valorisé même si celle-ci n'aboutit pas.
4. De la tyrosine à une protéine
La tyrosine (TYR) entre dans la composition de protéines appartenant à la famille des endorphines. Ces composés sont sécrétés, par exemple, lors d'activités physiques intenses. Ils possèdent des capacités à éliminer la sensation de douleur et à procurer une sensation de bien-être. Une première liaison peptidique est créée par réaction de condensation entre la tyrosine et un autre acide aminé, la glycine (GLY) afin de former dans un premier temps, un dipeptide TYR-GLY suivant l'équation générale :
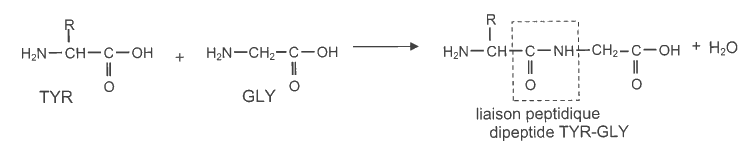
4.1. Sans aucune précaution particulière prise lors de cette synthèse, combien de dipeptides différents peut-on obtenir à partir de la tyrosine et de la glycine ? Utiliser une notation du type TYR-GLY pour rédiger votre argumentation.
4.2. La stratégie adoptée pour la synthèse peptidique utilise la protection et la déprotection de fonctions. Proposer, en quelques phrases, une stratégie qui permette de synthétiser uniquement le dipeptide TYR-GLY.
|