Carnet de bac
Annales
L'hélianthine, indicateur coloré |
➔ |
| Afrique 2015 - Exercice 1 - 5 points |
|
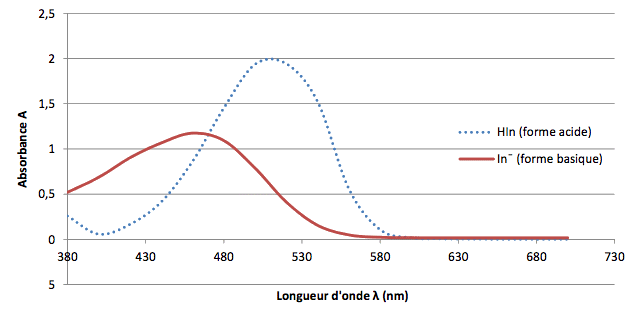
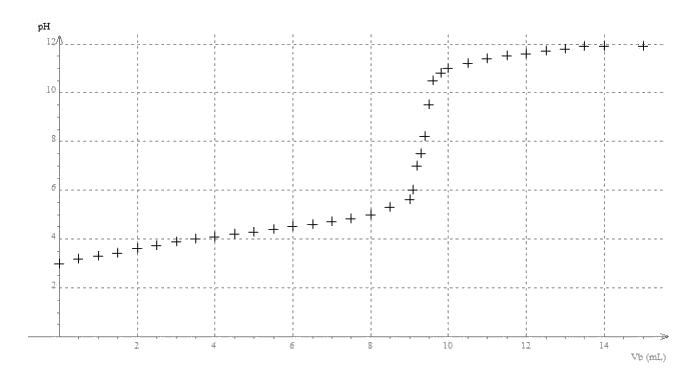
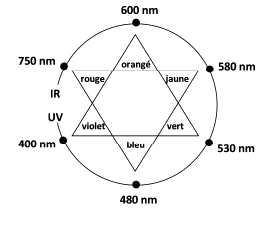
L’hélianthine, aussi appelée méthyl-orange, est un indicateur coloré de pH couramment utilisé pour la réalisation de titrages acidobasiques. Son nom provient de la famille des fleurs « héliante » (du grec helios = soleil et anthos = fleurs) dont les couleurs s’étendent du rouge au jaune.
Le protocole de cette étape est décrit ci-dessous :
1. Choisir parmi les trois termes suivants celui qui qualifie l’étape de préparation de la solution d’acide sulfanilique : addition, dissolution, dilution.
Données :
|
|||||||||||