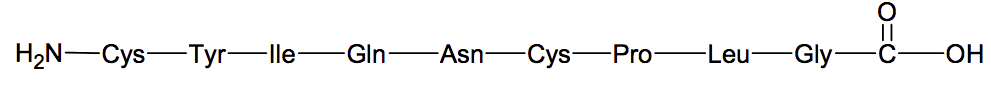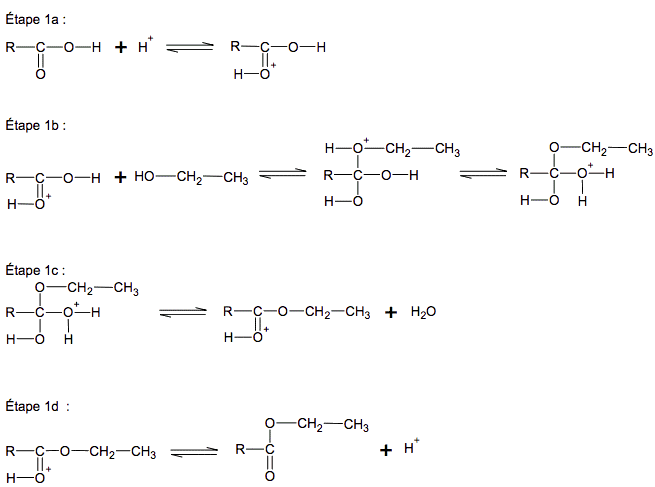Carnet de bac
Annales
L'ocytocine, une hormone peptidique de synthèse |
|
| Métropole 2015 (remplacement) - Exercice 1 - 4 points |
|
En 1955, Vincent du Vigneaud obtient le prix Nobel de chimie pour ses travaux sur les hormones. Il a déterminé la structure et réalisé pour la première fois la synthèse de deux hormones polypeptidiques : l'ocytocine qui agit sur les contractions de l'utérus et la vasopressine qui influe sur la pression sanguine. Dans cet exercice, on s’intéresse au début de la synthèse de l'ocytocine. L’ocytocine est un polypeptide constitué à partir de neuf acides α-aminés tels que la cystéine (Cys), la proline (Pro), l'asparagine (Asn), la glycine (Gly), la leucine (Leu)…
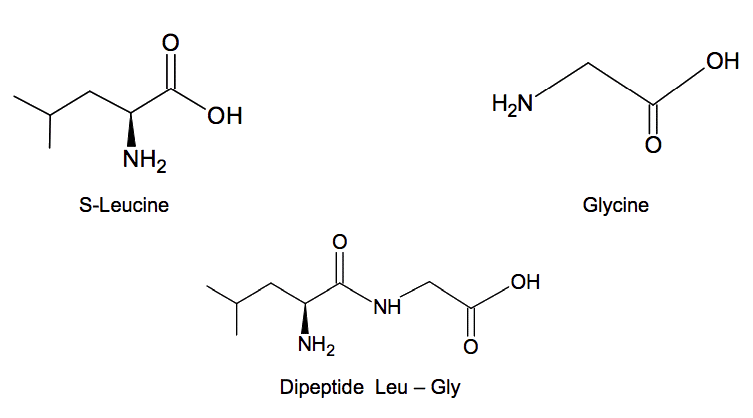
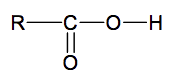
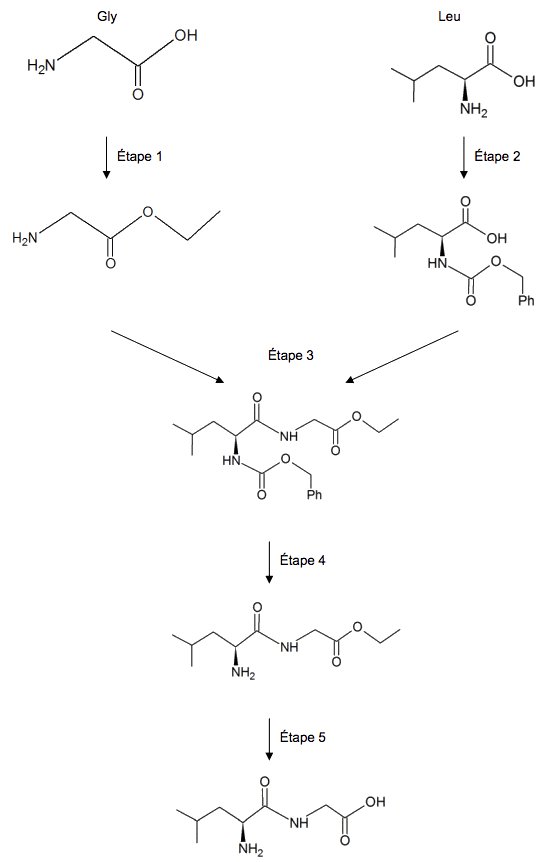
L'un des principaux problèmes rencontré lors de cette synthèse réside dans le fait que l'on souhaite synthétiser exclusivement le dipeptide Leu – Gly et non les dipeptides résultant d'autres combinaisons entre la glycine et/ou la leucine. Certains groupes d'atomes de la glycine et de la leucine doivent donc être momentanément protégés afin de procéder au couplage des deux acides α-aminés. Une fois le produit de ce couplage formé :
1. Structure du dipeptide Leu – Gly
|
|
Document 1. Succession simplifiée des étapes de la synthèse du dipeptide Leu – Gly
|
|
Document 2. Mécanisme réactionnel détaillé de l'étape 1 de la synthèse du dipeptide Leu – Gly
|