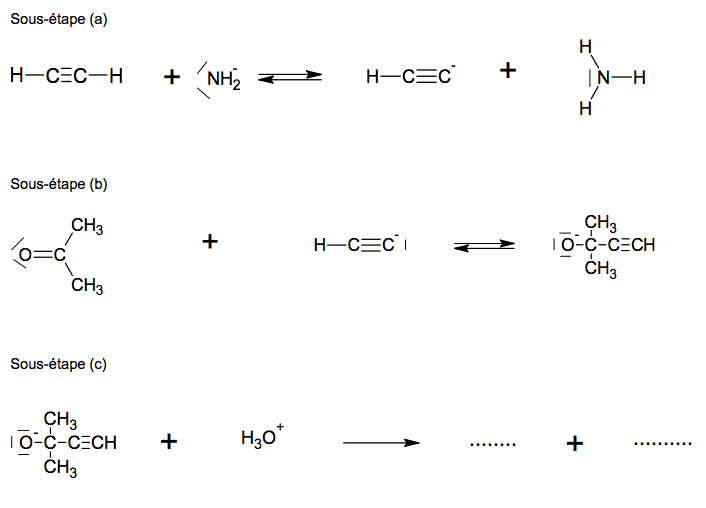|
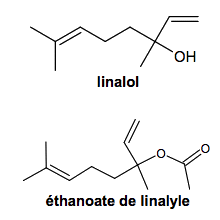
Le linalol et l’éthanoate de linalyle sont des composés odorants principalement utilisés pour les parfums, cosmétiques, savons, … Principales espèces chimiques présentes dans la lavande fine (lavandula officinalis) et du lavandin (lavandula hybrida), elles peuvent être extraites de ces fleurs par hydrodistillation. Elles peuvent aussi être synthétisées. Le linalol est obtenu à partir de la propanone et l’éthanoate de linalyle est obtenu à partir du linalol.
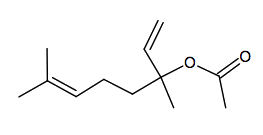
1. Les molécules d’éthanoate de linalyle et de linalol
1.1. Sur la formule topologique de la molécule d’éthanoate de linalyle, donnée en annexe à rendre avec la copie, entourer le(s) groupe(s) caractéristique(s) et nommer la (ou les) famille(s) chimique(s) correspondante(s).
1.2. Lors de la synthèse de l’éthanoate de linalyle à partir du linalol racémique, on obtient un mélange de plusieurs stéréoisomères.
1.2.1. La molécule d’éthanoate de linalyle possède-t-elle des carbones asymétriques ? Justifier et les indiquer, à l’aide d’un astérisque, sur la formule topologique donnée en annexe à rendre avec la copie.
1.2.2. La molécule d’éthanoate de linalyle présente-t-elle une diastéréoisomérie de type Z/E ? Justifier la réponse.
1.2.3. Donner, en conclusion, le type de stéréoisomèrie présent dans le mélange obtenu lors de la synthèse.
1.3. Le linalol a pour nom systématique : 3,7-diméthylocta-1,6-dièn-3-ol.
1.3.1. Justifier ce nom en précisant le raisonnement suivi.
1.3.2. Identifier le groupement R qui apparaît dans la formule simplifiée du linalol ci-dessous.
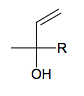
1.3.3. La molécule de linalol présente deux énantiomères. Donner la représentation de Cram de ces deux énantiomères en utilisant la formule simplifiée ci-dessus.
2. Synthèse du linalol
La synthèse du linalol s’effectue en six étapes décrites ci-dessous.
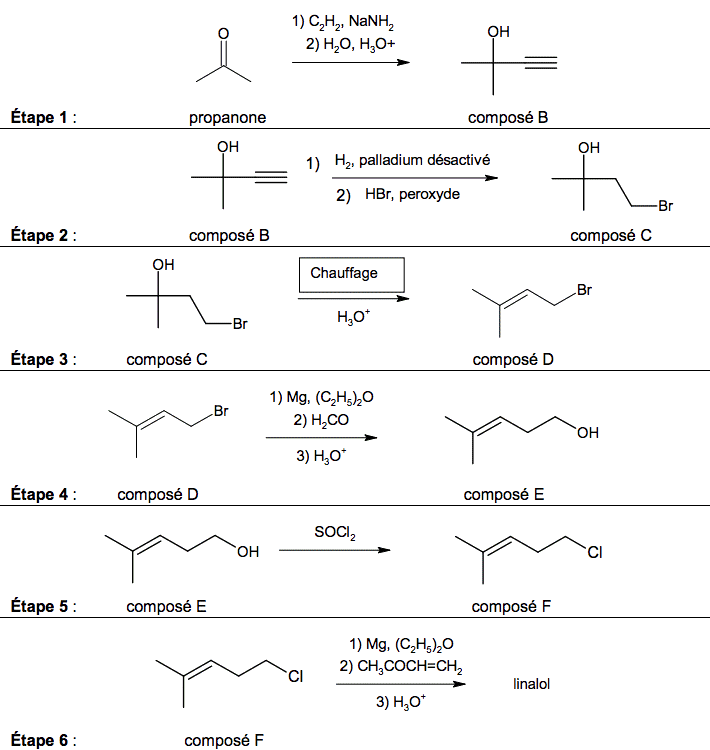
2.1. Associer aux étapes 3 et 5 de la synthèse, en justifiant votre choix, une catégorie de réaction parmi les catégories suivantes : élimination, addition, substitution.
2.2. Pour les étapes 4 et 5 de la synthèse, indiquer s’il s’agit d’une modification de chaîne et/ou d’une modification de groupe caractéristique.
2.3. Le mécanisme réactionnel de l’étape 1 est donné en annexe à rendre avec la copie. Compléter le mécanisme des sous-étapes (a) et (b) avec les flèches courbes et les doublets non liants. Indiquer les produits formés manquants dans la sous-étape (c).
2.4. Le spectre infrarouge du produit obtenu lors de l’étape 6 est représenté ci-dessous. Quel (s) élément(s), dans ce spectre, permet(tent) de montrer sans ambiguïté, qu’il y a bien eu formation de linalol lors de cette étape ?
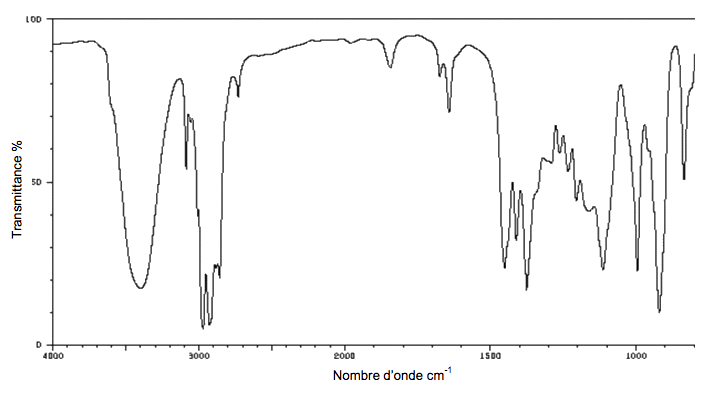
Extrait d’une table de données de spectroscopie I.R. :
| Liaison | C=C ester | C=O cétone | C=O | CO−H | C−O |
| Nombre d’onde (cm-1) | 1620 - 1680 | 1730 - 1750 | 1705 - 1725 | 3200 - 3500 | 1050 - 1450 |
3. Différentes méthodes pour synthétiser l’éthanoate de linalyle
Il existe plusieurs méthodes pour synthétiser l'éthanoate de linalyle. On peut faire réagir le linalol soit avec un acide carboxylique soit avec un anhydride d'acide.
| Nom de l’espèce chimique | Éthanoate de linalyle | Linalol | Acide éthanoïque | Anhydride éthanoïque | Acide sulfurique |
| Densité | 0,89 | 0,87 | 1,05 | 1,08 | 1,83 |
| Température d'ébullition (°C) sous pression atmosphérique | 220 | 199 | 118 | 139 | 337 |
| Masse molaire(g·mol-1) | 196 | 154 | 60 | 102 | 98 |
| Pictogrammes de sécurité |  |  |  |  |  |
| Mentions de danger | H315
H319 | H315
H319
H335 | H226
H314 | H226 H302
H314 H332 | H 290
H 314 |
Masse volumique de l’eau : ρeau = 1,0 g·mL-1
Quelques mentions de danger :
- H226 : Liquide et vapeurs inflammables ;
- H290 : Peut être corrosif pour les métaux ;
- H302 : Nocif en cas d'ingestion ;
- H314 : Provoque des brûlures de la peau et lésions oculaires graves ;
- H315 : Provoque une irritation cutanée ;
- H319 : Provoque une sévère irritation des yeux ;
- H332 : Nocif par inhalation ;
- H335 : Peut irriter les voies respiratoires.
3.1. Première méthode : obtention de l’éthanoate de linalyle à partir de l’acide éthanoïque.
Pour obtenir de l’éthanoate de linalyle, on chauffe à reflux du linalol avec un excès d'acide éthanoïque, en présence d'acide sulfurique. On obtient, après séparation, rinçage et séchage, l'éthanoate de linalyle. Le rendement de cette synthèse, modélisée ci-dessous, est de 5 %.

3.1.1. Écrire l’équation de la réaction de synthèse.
3.1.2. Quel est le rôle d’un chauffage à reflux ?
3.1.3. L’acide sulfurique joue le rôle de catalyseur. Parmi les caractéristiques d’une transformation chimique, proposées ci-après, indiquer celle(s) qui est (sont) modifiée(s) par ajout d’un catalyseur :
la cinétique, la composition finale du mélange, le mécanisme réactionnel.
3.2. Deuxième méthode : obtention de l’éthanoate de linalyle à partir de l’anhydride éthanoïque.
On réalise le chauffage à reflux de 10,0 mL de linalol et d’un excès d’anhydride éthanoïque. On obtient, après séparation, rinçage et séchage, 8,4 g d’éthanoate de linalyle. Cette transformation, modélisée ci-dessous, est rapide.

3.2.1. Indiquer les précautions à prendre lors de cette synthèse. Justifier.
3.2.2. Déterminer le rendement de cette synthèse.
3.3. En fin de synthèse, on réalise le spectre R.M.N. du proton du produit obtenu, afin de s’assurer qu’il s’agit bien de l’éthanoate de linalyle. Quel(s) changement(s) (nombre et multiplicité des signaux, courbe d’intégration) va-t-on observer sur le spectre du produit obtenu par rapport à celui du linalol ?
3.4. D’après les informations fournies, comparer les deux méthodes proposées pour synthétiser l'éthanoate de linalyle.
|