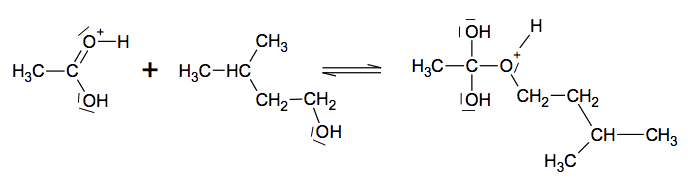|
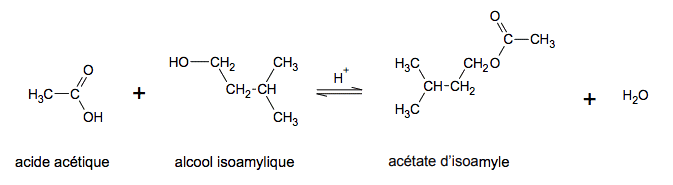
Les esters sont des composés organiques volatils souvent utilisés pour produire des arômes et des fragrances synthétiques. L’ester étudié dans cet exercice est l’acétate d’isoamyle, un ester dont la saveur et l’odeur sont ceux de la banane. L’équation de la réaction de la synthèse, en présence d’acide sulfurique, s’écrit :
L’objectif de cet exercice est de comparer plusieurs protocoles de synthèse de l’acétate d’isoamyle.
Données :
Caractéristiques physico-chimiques :
| Espèces chimiques | Propriétés physiques | Pictogrammes |
| Alcool isoamylique | M = 88,1 g·mol–1
Teb = 128 °C
ρ = 0,81 g·mL–1
Très peu soluble dans l’eau |  |
| Acide acétique | M = 60,1 g·mol–1
Teb = 118 °C ρ = 1,05 g·mL–1
Très soluble dans l’eau |  |
| Acétate d’isoamyle | M = 130,2 g·mol–1
Teb = 142 °C ρ = 0,87 g·mL–1
Très peu soluble dans l’eau |  |
| Acide sulfurique | Très soluble dans l’eau |  |
Électronégativité de quelques éléments :
| Atome | H | C | O |
| Électronégativité | 2,2 | 2,5 | 3,4 |
Chimie verte : La notion de chimie verte date de 1991, l'agence américaine pour la protection de l'environnement en propose la définition suivante : « la chimie verte a pour but de concevoir des produits et des procédés
chimiques permettant de réduire ou d’éliminer l’utilisation et la synthèse de substances dangereuses » et énonce les 12 principes :
Les 12 principes de la chimie verte :
| 1. Prévention | 7. Utilisation de matières premières renouvelables |
| 2. Économie d’atomes | 8. Réduction des sous-produits et intermédiaires |
| 3. Synthèses chimiques moins nocives | 9. Utilisation de catalyseurs (non polluants) |
| 4. Conception de produits chimiques plus sécuritaires | 10. Conception de substances non persistantes |
| 5. Solvants et auxiliaires plus sécuritaires | 11. Analyse en temps réel pour éviter tout risque de pollution |
| 6. Amélioration du rendement énergétique | 12. Chimie sécuritaire pour prévenir les accidents |
culturesciences.chimie.ens.fr/content/la-chimie-verte-1055
Rayonnement micro-ondes : Un four à micro-ondes est un appareil électroménager utilisé principalement pour le chauffage rapide d’aliments, par agitation des molécules d’eau qu’ils contiennent, ces molécules absorbant le
rayonnement de fréquence 2,45 GHz émis par le four. Cette technologie est principalement utilisée dans la cuisine mais, depuis une vingtaine d’années, les fours à micro-ondes sont largement utilisés dans les
laboratoires de chimie pour activer des réactions chimiques. … Cette application peut être considérée comme faisant partie de la « chimie verte ».
D’après Eduardo RUIZ-HITZKY, Le four micro-ondes : de la cuisine à la chimie de synthèse, L’annuaire du Collège de France
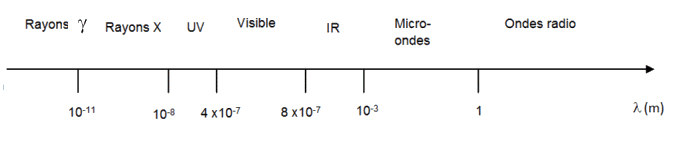
Spectre des ondes électromagnétiques :
1. Réaction de synthèse de l’acétate d’isoamyle et mécanisme réactionnel
1.1. Quels sont les noms, en nomenclature officielle, de l’acide acétique et de l'alcool isoamylique ? Les deux premières étapes du mécanisme réactionnel de synthèse de l’acétate d’isoamyle sont données ci-dessous.
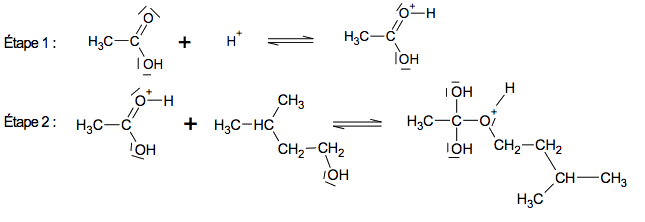
1.2. Compléter sur l’annexe à rendre avec la copie le mécanisme réactionnel de l’étape à l’aide de flèches courbes, puis indiquer la catégorie de réaction de l’étape.
1.3. Les ions H+, provenant de l’acide sulfurique, jouent le rôle de catalyseurs de la réaction. Que peut-on attendre lors d’une autre étape du mécanisme réactionnel de cette réaction de synthèse ?
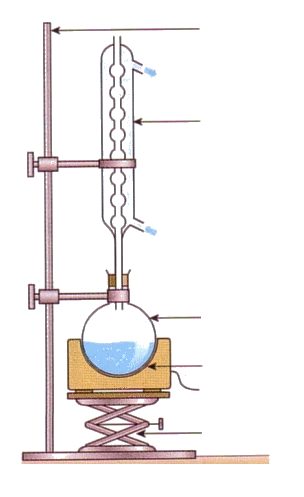
2. Synthèse de l’acétate d’isoamyle par chauffage à reflux
On réalise cette synthèse au laboratoire en mettant en œuvre le protocole expérimental suivant :
- introduire 0 mL d’alcool isoamylique, 15 mL d’acide acétique, quelques grains de pierre ponce et 1 mL d’acide sulfurique concentré dans le ballon ;
- chauffer à reflux en maintenant une ébullition douce pendant 30 min ;
- laisser refroidir, puis transférer le contenu du ballon dans une ampoule à décanter. Éliminer la phase aqueuse ;
- sécher la phase organique ;
- purifier l’ester par chromatographie sur colonne.
Cette synthèse permet d’obtenir un volume d’ester égal à 0,4 mL.
2.1. Compléter, sur l’annexe à rendre avec la copie, le montage utilisé lors de la mise en œuvre de la synthèse en indiquant le nom du matériel et les espèces chimiques présentes. Identifier et justifier les éléments de sécurité présents dans ce montage et ceux que doit utiliser le technicien de laboratoire.
2.2. Montrer que l’acide acétique est introduit en excès.
2.3. Déterminer la valeur du volume d’ester attendu lors de cette synthèse si la transformation était totale.
2.4. Si on réalisait cette synthèse avec un mélange équimolaire des réactifs, son rendement serait égal à 65 %. Le choix d’introduire un réactif en excès par rapport à un mélange équimolaire des deux réactifs a-t-il permis d’améliorer le rendement de la synthèse ?
3. Synthèse de l’acétate d’isoamyle par micro-ondes
On réalise une deuxième synthèse, dans un four à micro-ondes, en mettant en œuvre le protocole expérimental suivant :
- Introduire, dans un erlenmeyer sec, un mélange équimolaire de 0,18 mol d’alcool isoamylique et 0,18 mol d’acide acétique. Ajouter 1 mL d’acide sulfurique concentré.
- Positionner l’erlenmeyer sur le bord du plateau tournant du four à micro-ondes et l’irradier à une puissance de 800 W pour une durée totale d’irradiation de 30 s.
- Laisser refroidir le mélange, puis procéder à une extraction liquide-liquide.
- Filtrer et sécher pour récupérer l’ester.
Les conditions expérimentales de cette synthèse permettent d’obtenir un rendement égal à 80 %.
3.1. Justifier, en utilisant le spectre des ondes électromagnétiques, que le four décrit appartient à la catégorie des fours à micro-ondes.
3.2. Déterminer la valeur de l’énergie consommée par le four à micro-ondes lors de la synthèse de l’acétate d’isoamyle, puis la comparer à l’énergie apportée pour le chauffage à reflux et estimée à 270 kJ.
3.3. Proposer une interprétation, au niveau microscopique, du principe de chauffage par micro-ondes.
3.4. Présenter des arguments justifiant l’intérêt d’utiliser un four à micro-ondes, pour cette synthèse, dans le cadre de la chimie verte.
|