Carnet de bac
Annales
Du jus de pomme au vinaigre |
|
| Polynésie 2016 - Exercice 3 - 5 points |
|
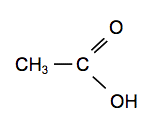
Le vinaigre de cidre est obtenu par double fermentation de jus de pomme, la fermentation alcoolique et la fermentation acétique. La fermentation alcoolique est due à l’oxydation du glucose contenu dans le jus de pomme en présence de levures. Il se forme de l’éthanol et du dioxyde de carbone. On obtient du cidre. La principale transformation du cidre en vinaigre est due à des micro-organismes, Mycoderma acetii, qui fixent les molécules de dioxygène sur l’éthanol, ce qui conduit à la formation d’acide acétique. Cette transformation est appelée fermentation acétique.
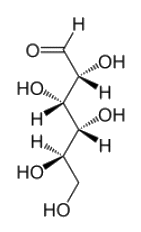
Le glucose linéaire se trouve sous deux formes énantiomères, le D-glucose et le L-glucose. Lors de la fermentation alcoolique, seul le D-glucose majoritairement présent dans la nature se transforme sous l'effet de la zymase, une enzyme produite par des levures. La représentation de Cram de la molécule de D-glucose est donnée ci-contre.
D’après « Décret n°88-1207 du 30 décembre 1988, modifié par n°2005-553 du 19 mai 2005 »
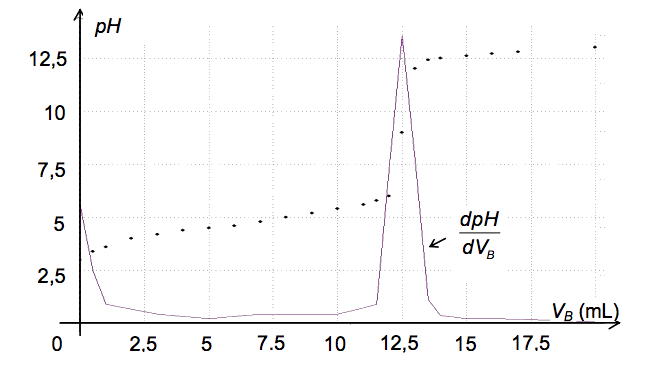
Déterminer si le cidre mis en fermentation depuis plusieurs semaines et analysé ci-dessus peut être commercialisé sous l’appellation vinaigre. Toute prise d’initiative et toute démarche, même partielle, sera valorisée.
|