|
Au XIXème siècle, une boisson à base de feuilles de coca et de noix de cola était préconisée par son inventeur comme remède contre les problèmes gastriques. Cette boisson est actuellement vendue comme soda. Sur l’étiquette de cette boisson, on peut lire la liste d’ingrédients suivante : eau gazéifiée au dioxyde de carbone ; sucre ; colorant (caramel) ; conservateur (acide benzoïque) ; acidifiant (acide phosphorique) ; extraits végétaux ; arômes naturels (extraits végétaux dont caféine). Dans cet exercice on s’intéresse à différentes espèces chimiques présentes dans la composition de cette boisson.
Données :
- pH de la boisson étudiée : 2,5 ;
- Masse molaire de la caféine : M = 194,0 g·mol-1 ;
- Numéros atomiques et masses molaires atomiques :
|
H |
C |
N |
O |
P |
| Z |
1 |
6 |
7 |
8 |
15 |
| M (en g·mol-1) |
1,0 |
12,0 |
14,0 |
16,0 |
31,0 |
- Informations sur des réactifs et des produits de la synthèse de l’acide benzoïque :
| Benzonitrile |
Acide benzoïque |
Hydroxyde de sodium |
C7H5N
M = 103,04 g·mol-1
Tfusion = - 12,8 °C
Tébullition = 190,7 °C
Masse volumique : ρ = 1,01 g·mL-1
Pictogramme de danger : 
|
C7H6O2
M = 122,12 g·mol-1
Tfusion = 122,4 °C
Tébullition = 249,9 °C
pKa(C7H6O2/C7H5O2-) = 4,2
Pictogramme de danger : 
|
NaOH
M = 40,00 g·mol-1
Tfusion = 318 °C
Pictogramme de danger : 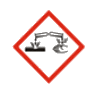
|
- La Dose Journalière Admisssible (DJA) est la dose maximale d’une substance (exprimée en mg par kg de masse corporelle et par jour) à laquelle on peut être exposé de façon répétée sans risque pour la santé :
|
Acide phosphorique |
Acide benzoïque |
Ion benzoate |
Caféine |
DJA adulte
(mg·kg-1·jour-1) |
70 |
5 |
|
5 |
Solubilité dans l’eau
(g·L-1) |
|
à 0°C |
à 25°C |
à 25°C |
|
| 1,7 |
3,4 |
650 |
Pour un enfant de 30 kg, l’apport quotidien de caféine ne doit pas dépasser 75 mg, ce qui correspond environ à deux canettes de soda de 33 cL.
1. La caféine
La formule topologique de la molécule de caféine est représentée ci-contre :
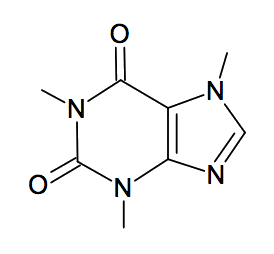
1.1. Recopier et compléter la formule topologique de la molécule de caféine en faisant figurer les doublets non liants.
1.2. Déterminer la formule brute de la caféine.
1.3. À l’aide des données fournies, évaluer la concentration molaire approximative de la caféine dans le soda.
2. L’acide benzoïque
L’acide benzoïque est un conservateur alimentaire souvent présent dans les sodas. Une méthode de synthèse de l’acide benzoïque peut s’effectuer en deux étapes au laboratoire.
• Étape (a) : obtention de l’ion benzoate à partir du benzonitrile
C7H5N(ℓ) + H2O(ℓ) + HO–(aq) → C7H5O2–(aq) + NH3 (aq)
• Étape (b) : obtention de l’acide benzoïque par réaction de l’ion benzoate avec l’ion oxonium
C7H5O2–(aq) + H3O+(aq) → C7H6O2 (s) + H2O(ℓ)
Le but de cette partie est d’analyser un protocole mis en œuvre pour effectuer cette synthèse au laboratoire ; la description des opérations successives figure ci-dessous.
➀ Dans un ballon de 100 mL, introduire un volume de 2,0 mL de benzonitrile, un volume de 24 mL d’une solution aqueuse d’hydroxyde de sodium à 100 g·L-1 et quelques grains de pierre ponce.
➁ Adapter un réfrigérant à eau, puis porter à ébullition pendant plusieurs dizaines de minutes.
➂ Une fois la réaction terminée, verser le contenu du ballon dans un bécher, puis le refroidir à l’aide d’un bain de glace.
➃ Ajouter de l’acide chlorhydrique froid en excès.
➄ Filtrer sur Büchner (penser à laver les cristaux avec une solution froide acidifiée).
➅ Placer les cristaux à l’étuve (enceinte chauffante thermostatée) pendant une heure.
➆ Peser le produit obtenu.
2.1. Dans l’opération ➀ peut-on remplacer la solution aqueuse d’hydroxyde de sodium par des pastilles d’hydroxyde de sodium solide pour réaliser la synthèse ? Justifier.
2.2. Quelles opérations correspondent à l’étape (a) de la synthèse de l’acide benzoïque ?
2.3. Donner deux raisons qui justifient l’utilisation du chauffage à reflux.
2.4. Donner les rôles de chacune des opérations ➃ , ➄ et ➅.
2.5. Quel critère doit-on choisir pour régler une température de l’étuve adaptée à l’opération ➅. Justifier votre choix.
2.6. Citer deux méthodes permettant de vérifier la nature du produit obtenu.
2.7. Quelle masse maximale d’acide benzoïque peut être obtenue par la mise en œuvre de ce protocole ?
2.8. L’étiquette sur la bouteille de soda indique la présence d’acide benzoïque comme conservateur. Est-ce bien sous cette forme que l’espèce prédomine dans cette boisson ? Justifier.
3. L’acide phosphorique
Des études récentes laissent penser que l’acide phosphorique, H3PO4, contenu dans certains sodas au cola est responsable d’un accroissement des risques d’insuffisance rénale et d’ostéoporose s’il est consommé en quantités trop importantes. Cette partie vise à évaluer la consommation maximale de soda sans que l’acide phosphorique présente un risque pour la santé.
Dosage de l’acide phosphorique dans le soda étudié
Pour déterminer la concentration en acide phosphorique dans le soda, on dégaze un volume V=10,0 mL de soda afin d’éliminer le dioxyde de carbone dissous. On réalise ensuite le titrage de la boisson dégazée par une solution aqueuse d’hydroxyde de sodium (Na+(aq) ; HO-(aq)) de concentration molaire C=1,0·10-2 mol·L-1. Le titrage est suivi par pH-métrie. On donne ci-dessous les mesures effectuées lors de ce titrage, V étant le volume de solution d’hydroxyde de sodium versé :
| V (mL) |
0 |
1,0 |
2,0 |
3,0 |
4,0 |
5,0 |
6,0 |
7,0 |
8,0 |
9,0 |
10,0 |
| pH |
2,9 |
3,1 |
3,2 |
3,3 |
3,6 |
4,5 |
5,8 |
6,2 |
6,3 |
6,4 |
6,4 |
Dans cette partie, on admet que seul le couple H3PO4(aq)/H2PO4-(aq) intervient et que l’acide benzoïque étant en faible quantité, sa présence influe très peu sur le dosage de l’acide phosphorique.
Combien de bouteilles de soda de 1,5 L une personne adulte peut-elle consommer par jour, sans que l’acide phosphorique ne présente un risque pour la santé ?
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n’a pas abouti. la démarche est évaluée et nécessite d’être correctement présentée.
|




