Carnet de bac
Annales
Contrôle d'un vin |
|
| Afrique 2015 - Exercice 3 - 5 points |
|
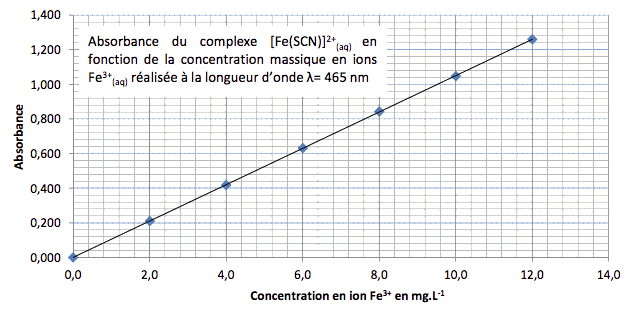
Un vin blanc pétillant, en fin d’élaboration, est étudié dans un laboratoire afin de subir des contrôles de qualité. On se propose dans cet exercice de contrôler la teneur en fer dans ce vin, ainsi que l’acidité totale qui en sont deux critères de qualité : l’un pour la prévention de la formation d’un précipité rendant le vin trouble (casse ferrique) et l’autre pour prévoir les traitements à faire pendant la vinification.
Fe3+(aq) + SCN−(aq) → [Fe(SCN)]2+(aq)
1. Détermination de la teneur en fer du vin
H2A(aq) + 2 HO− → A2− (aq) + 2 H2O
Montrer que la concentration massique Cm en acide tartrique équivalent dans le vin est donnée par la relation : \(\displaystyle\mathrm { C_m= \frac{C_B \ V_E \ M }{2 \ V} }\) où M désigne la masse molaire de l’acide tartrique.
\(\displaystyle\mathrm { U_{C_m}= 2 \ C_m \sqrt{ \left(\frac{u_{C_B}}{C_B} \right)^2 + \left(\frac{u_{V_E}}{V_E} \right)^2 + \left(\frac{u_V}{V} \right)^2 } }\) 2.6. Ce vin est-il propre à la consommation ? |
||||