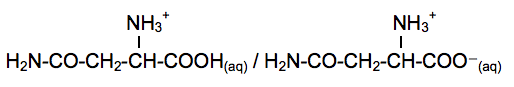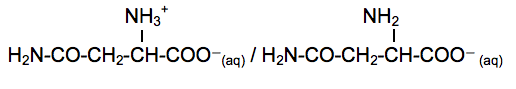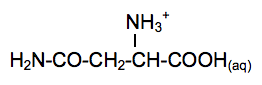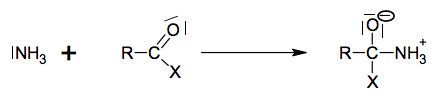Carnet de bac
Annales
Un acide aminé au rôle majeur, la glutamine |
|
| Polynésie 2018 - Exercice 3 - 5 points |
|
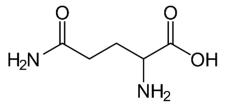
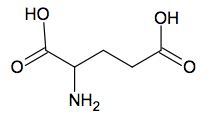
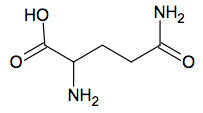
Acide aminé le plus abondant dans l’organisme, la glutamine et particulièrement la L-glutamine joue un rôle fondamental pour la régulation acido-basique du sang. La glutamine est synthétisée par l’organisme humain à partir de l’acide glutamique, autre acide aminé non essentiel. L’enzyme qui permet cette conversion s’appelle la glutamine synthétase. La glutamine est particulièrement utilisée par les sportifs de haut niveau pour améliorer les performances physiques.
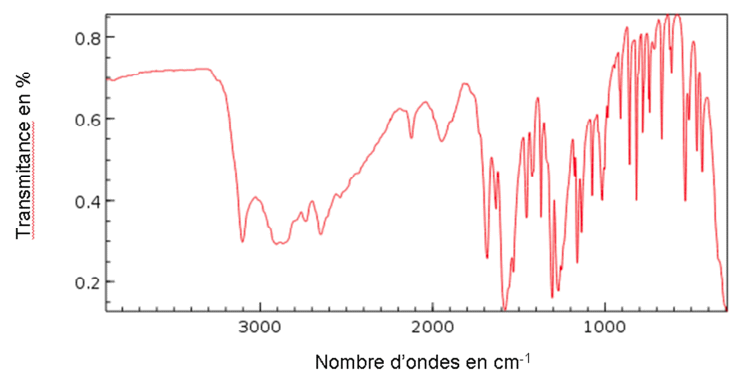
2.3.1. Donner trois arguments justifiant que le spectre IR proposé ci-dessous peut correspondre à celui de la glutamine.
|
|||||||||||||||||||||||||||||||||||||||||||