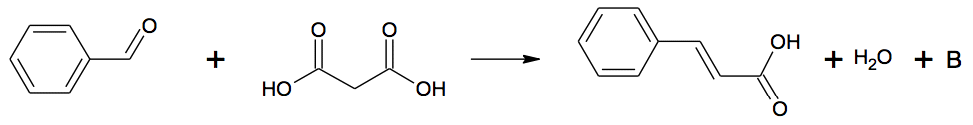Carnet de bac
Annales
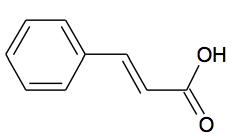
L'acide cinnamique |
|
| Pondichéry 2018 - Exercice 3 - 5 points |
|
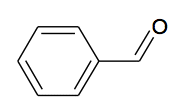
L’acide cinnamique est utilisé dans l'industrie des parfums, des saveurs, des cosmétiques et dans l'industrie pharmaceutique. Il est présent dans certaines plantes comme le xuan shen (scrophularia ningpoensis). Il s’agit d’une plante vivace qui pousse en Asie et principalement en Chine. Il peut également être facilement synthétisé en laboratoire à faible coût.
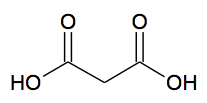
C6H5-CH=CH-COOH + C5H5N → C6H5-CH=CH-COO- + C5H5NH+
|
||||||||||||