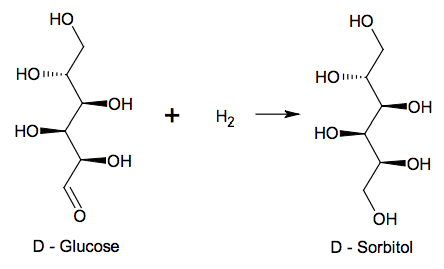Carnet de bac
Annales
Vitamine C |
|
| Métropole 2018 - Exercice 1 - 4 points |
|
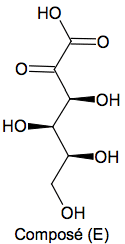
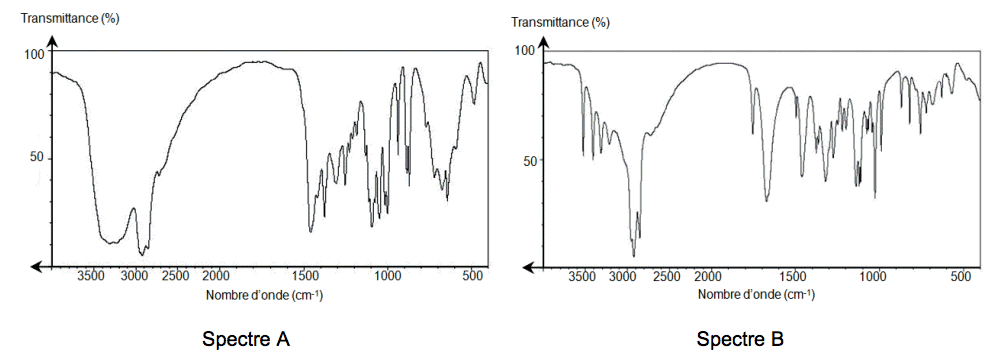
L'acide ascorbique, communément appelé vitamine C, est un antioxydant présent dans de nombreux fruits et légumes. Une carence prolongée en vitamine C provoque une maladie appelée scorbut. En pharmacie, il est possible de trouver l'acide ascorbique, sous forme de comprimés de vitamine C 500, chacun contenant 500 mg de vitamine C. L’objectif de l’exercice est d’étudier une voie de synthèse industrielle de l’acide ascorbique puis de vérifier la valeur de la masse d’acide ascorbique contenue dans un comprimé.
C6H8O6 (aq) + HO-(aq) → C6H7O6-(aq) + H2O
2.1. Réaliser un schéma légendé du dispositif expérimental utilisé pour réaliser le titrage.
|
|||||||||||||||||||