|

Il existe en France des sols favorables à la trufficulture. L'analyse des différentes caractéristiques du sol est déterminante pour juger de son aptitude à héberger des truffes. Le but de cet exercice est d'étudier trois analyses portant sur un échantillon du sol d'un ancien vignoble afin de déterminer si celui-ci est propice à la culture des truffes.
Caractéristiques d'un sol truffier :
Les truffières sont souvent implantées sur d'anciennes vignes qui ont reçu d'importantes quantités de cuivre sous forme de bouillie bordelaise (sulfate de cuivre et chaux) pendant des décennies et plus récemment des fongicides organo-cupriques. Ces traitements répétés ont pour conséquence un enrichissement en cuivre dans les couches supérieures. Dans les sols, la teneur totale en cuivre est de l'ordre de 20 mg/kg de terre et peut varier entre 3 et 100 mg sans incidence sur la végétation. On considère qu'un sol n'est pas propice aux truffes au-delà de 100 mg d'ions cuivre par kg de sol. D'après La truffe, la terre, la vie de Gabriei Callot, Collection du Labo au terrain, éditions INRA
Un sol truffier est calcaire c'est-à-dire riche en carbonate de calcium CaCO3 (s). Le pourcentage massique en carbonate de calcium CaCO3(s) d'un sol truffier doit être compris entre 20 % et 60 %. Le pH d'un sol truffier doit être compris entre 7,5 et 8,5.
Données à 25 °C :
- pKA de couples acido-basiques :
- pKA(CO2,H2O/HCO-3 (aq))= 6,4 ;
- pKA(HCO-3 (aq) / CO2-3 (aq)) =10,3 ;
- Masses molaires : M(CaCO3) = 100,1 g·mol-1 ; M(Cu2+) = 63,5 g·mol-1 ;
1. Le pH du sol
Le pH des sols calcaires dépend de la réaction entre l'eau, le dioxyde de carbone et le carbonate de calcium. Lorsque le dioxyde de carbone contenu dans l'atmosphère se dissous dans l'eau de pluie, on observe au niveau du sol la réaction acido-basique suivante :
Réaction 1 : CaCO3 (s) + CO2,H2O → Ca2+(aq) + 2 HCO-3 (aq)
On introduit un échantillon de sol à analyser dans de l'eau distillée. Après agitation on laisse reposer puis on filtre. La concentration molaire en ions oxonium de la solution obtenue est : [H3O+(aq)] = 1,25·10-8 mol·L-1
1.1 Vérifier que les conditions de pH sont favorables à la culture de la truffe.
1.2 Identifier, sur un axe gradué en fonction du pH, les domaines de prédominance des espèces acide-basiques : HCO-3 (aq) ; CO2-3 (aq) et CO2,H2O. En déduire l'espèce prédominante dans la solution aqueuse de sol préparée. Ce résultat est-il cohérent avec la réaction ? Justifier.
1.3 Écrire l'équation de la réaction acido-basique mise en jeu entre le dioxyde de carbone dissous CO2,H2O et l'eau.
1.4 Expliquer comment évoluerait le pH du sol si la quantité de dioxyde de carbone dissous venait à augmenter ?
2. La teneur en calcaire du sol
Un test rapide permettant de savoir si un sol contient du carbonate de calcium consiste à verser un peu d'acide chlorhydrique concentré sur ce sol. Si une effervescence se produit, le sol est dit "calcaire”. Le test peut-être modélisé par la réaction d'équation suivante :
CaCO3 (s) + 2 (H3O+(aq) + Cl-(aq)) → Ca2+(aq) + 2 Cl-(aq) + CO2 (g) + 3 H2O(ℓ)
On peut utiliser cette réaction pour déterminer la teneur en carbonate de calcium d’un sol. Pour cela, on réalise le dispositif expérimental ci-dessous. On introduit de l'acide chlorhydrique en excès ; le gaz dégagé est recueilli au moyen d’une éprouvette graduée remplie au préalable d'eau. Le volume de gaz recueilli est V = 72 mL pour un échantillon de masse m = 1,2 g du sol à analyser. Dans les conditions de l'expérience, le volume d’une mole de gaz est égal à 24,1 L.
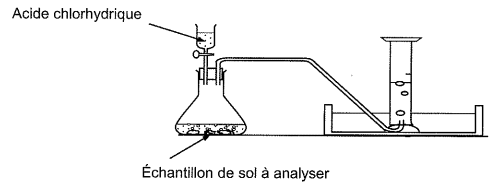
2.1. Expliquer pourquoi l'acide chlorhydrique doit être introduit en excès.
2.2.La quantité de calcaire dans le sol étudié convient-elle à la culture de la truffe ?
3. La teneur en cuivre du sol
À l’aide d'une fiole jaugée de 1,00 L, on prépare une solution aqueuse avec une masse m = 500,0 g de sol à analyser. Après agitation, traitement et filtration on obtient une solution « de sol » comprenant les ions cuivre Cu2+(aq). Les ions cuivre Cu2+(aq) présents en solution sont dosés par spectrophotométrie. Une série de solutions aqueuses de sulfate de cuivre (Cu2+(aq), SO42-(aq)) de volume V = 50,0 mL est préparée à partir d'une solution mère S0 de concentration molaire apportée en soluté C0 = 1,0·10-2 moL·L-1.
On mesure l'absorbance A de ces solutions à l'aide d’un spectrophotomètre pour une longueur d’onde du maximum d'absorption dans l’eau de l'ion Cu2+(aq) λmax=800 nm. On mesure ensuite l'absorbance AS de la solution de sol : AS = 0,035.
Les résultats sont les suivants :
| Solution | S1 | S2 | S3 | S4 | S0 |
Concentration de la solution
de sulfate de cuivre (mol·L-1) | 1,0·10-3 | 2,0·10-3 | 5,0·10-3 | 8,0·10-3 | 1,0·10-2 |
| Absorbance A | 0,010 | 0,019 | 0,045 | 0,082 | 0,103 |
3.1. Proposer une liste de matériel et un protocole nécessaire pour préparer la solution S3 à partir de la solution mère S0. Justifier.
3.2. Déterminer la concentration molaire en ions cuivre [Cu2+(aq)] de la solution de sol préparée.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie même si elle n’a pas abouti. La démarche suivie est évaluée et nécessite d’être clairement présentée.
3.3. En déduire la concentration massique CmS (ou teneur) en ions cuivre Cu2+(aq) dans le sol. Conclure.
4. Après ces différentes analyses, peut-on affirmer que l'échantillon de sol étudié est propice à la culture de la truffe ?
|



