|
Les différentes parties sont indépendantes.
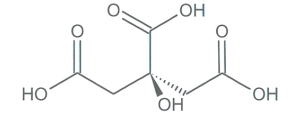
L'acide citrique est un triacide présent en abondance dans le citron. La synthèse mondiale approche les deux millions de tonnes par an. ll est utilisé dans les boissons, les cosmétiques, en pharmacie, etc.
Dans le commerce, on peut le trouver sous forme de poudre blanche anhydre ou monohydratée. Le but de cet exercice est d'étudier les propriétés acido-basiques de l’acide citrique, de trouver la forme présente dans un détartrant et de déterminer la pureté d’un produit commercial.
|
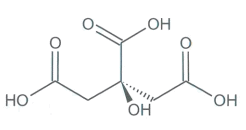
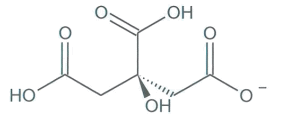
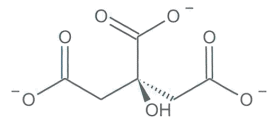
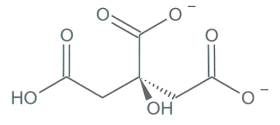
Représentation de la molécule d'acide citrique |
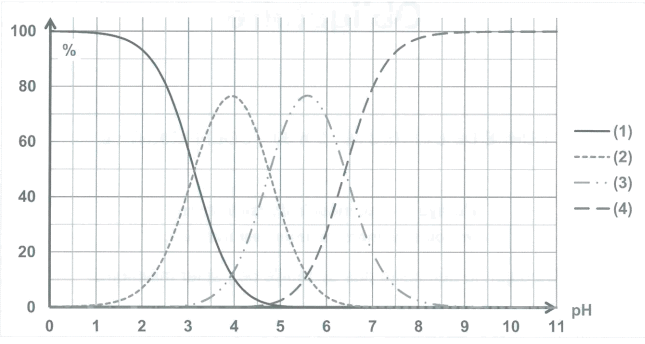
Document 1 : diagramme de distribution (pourcentage des espèces présentes) en fonction du pH et représentations des différentes espèces acido-basiques des couples de l’acide citrique.
1. Étude des propriétés acido-basiques de l’acide citrique
1.1. Rappeler ce qu'est un acide selon Brönsted, puis expliquer pourquoi l'acide citrique est qualifié de « triacide ».
1.2. Parmi les quatre espèces acide-basiques (a, b, c, d), indiquer celle qui prédomine en milieu très acide et celle qui prédomine en milieu très basique. Justifier.
1.3. Associer chaque espèce acido-basique a, b, c et d à une courbe 1, 2, 3 ou 4 du diagramme de distribution.
1.4. Le pH d'une solution aqueuse d'acide citrique de concentration 15 mmol·L-1 est d'environ 2,5. Quelle(s) est (sont) la(les) forme(s) (a, b, c et d) prédominante(s) de l'acide citrique dans cette solution ? Estimer leurs proportions relatives.
1.5. Indiquer à quelle grandeur acido-basique particulière correspond la valeur de pH égale à 3,2. Justifier.
1.6. L'acide citrique présente-t-il un atome de carbone asymétrique? Justifier la réponse.
2. Extraction de l’acide citrique d’un citron
L'acide citrique a été isolé en 1784 par Carl Wilhelm Scheele à partir de jus de citron.
L'extraction se déroule en différentes étapes décrites ci-dessous.
Extraire le jus d'un citron, puis le filtrer pour enlever la pulpe. Ajuster le pH à environ 9 en ajoutant une solution aqueuse d'ammoniac concentrée. Ajouter une solution aqueuse de chlorure de calcium, on observe alors la formation d'un précipité de citrate de calcium. Filtrer sous vide pour récupérer le solide formé. Amener le pH à une valeur inférieure à 1 en ajoutant une solution aqueuse d’acide sulfurique. Après agitation lente, on obtient une solution laiteuse.
Filtrer à nouveau cette solution, puis placer le filtrat dans une ampoule à décanter. Ajouter un peu d’éthanoate d'éthyle dans l'ampoule, puis, après agitation et décantation, jeter la phase aqueuse et récupérer la phase organique. L'acide citrique est ensuite isolé à l'aide d'un évaporateur rotatif qui va évaporer le solvant organique. Le spectre infra-rouge du produit extrait est réalisé.
Données
| Eau | Éthanoate d'éthyle |
| Densité | 1,0 | 0,92 |
Équation de dissolution du chlorure de calcium dans l'eau :
CaCl2 (s) → Ca2+(aq) + 2 Cl-(aq)
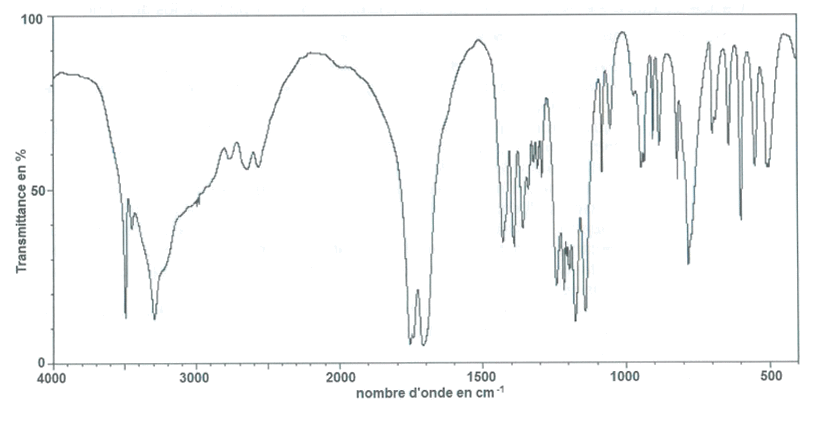
Table simplifiée de données pour la spectroscopie IR
| Liaison | Nombre d'onde (cm-1) |
| 0-H alcool | 3200 - 3400 |
| C-H | 2800 - 3000 |
| 0-H acide carboxylique | 2500 - 3200 bande large |
| C=O acide carboxylique | 1700 — 1725 |
| C=O aldéhyde | 1720 — 1740 |
2.1. L’acide citrique se trouve sous la forme b (appelée ion citrate) à la fin de l'étape 2 du protocole. Ecrire la formule brute de cet ion. En déduire la formule brute du précipité de citrate de calcium formé à l'étape 3.
2.2. Expliquer pourquoi le précipité de citrate de calcium disparaît au cours de l'étape 5.
2.3. Faire un schéma légendé de l'ampoule à décanter utilisée lors de l'étape 6, préciser les positions relatives des phases organique, aqueuse et de l'acide citrique. Justifier la position relative des deux phases.
2.4. Le spectre isolé après évaporation du solvant organique est représenté ci-dessous. Ce spectre confirme-t-il que le produit extrait du citron par ce protocole est de l'acide citrique ?
Spectre infrarouge
3. Analyse d’un détartrant à I’acide citrique
Un laboratoire d’ana|yse met en place un protocole afin de déterminer :
- la forme, anhydre ou monohydratée, de |"acide citrique présente dans un détartrant commercial en poudre ;
- la pureté de l’acide citrique dans le détartrant commercial en poudre.
Données
| Indicateur | Couleur | Domaine de virage |
| Forme acide | Forme basique |
| Jaune d'alizarine | Jaune | Violet | 10,1 à 12,1 |
| Thymolphtaléine | Incolore | Bleue | 9,3 à 10,5 |
| Rouge de crésol | Jaune | Rouge | 7,2 à 8,8 |
| Bleu de bromothymol | Jaune | Bleue | 6,0 à 7,6 |
| Rouge de méthyle | Rouge | Jaune | 4,2 à 6,2 |
| Vert de bromocrésol | Jaune | Bleue | 3,8 à 5,4 |
| Hélianthine | Rouge | Jaune | 3,1 à 4,4 |
| Formule brute | Masse molaire | Pictogramme |
| Acide citrique anhydre | C6H8O7 | 192 g·mol-1 |  |
| Acide citrique monohydraté | C6H8O7, H20 | 210 g·mol-1 |
Protocole utilisé au laboratoire :
poser une coupelle sur le plateau d’une balance et appuyer sur « TARE » ; mettre un peu de détartrant dans la coupelle, la balance indique alors : 
introduire le contenu de la coupelle dans un bécher, ajouter un peu d'eau distillée puis agiter pour dissoudre totalement le détartrant ; mettre le bécher sous une burette graduée remplie avec une solution aqueuse d’hydroxyde de sodium de concentration C = 5,0·10-2moI·L-1 ; placer une électrode de pH-métrie dans le bécher et la relier au pHmètre ; sous agitation magnétique, ajouter progressivement la solution aqueuse d’hydroxyde de sodium en relevant régulièrement la valeur du pH de la solution.
Équation de la réaction support du titrage :
C6H8O7 (aq) + 3 HO-(aq) → C6H8O3-7 (aq) + 3 H2O(aq)
Courbe obtenue en réalisant le protocole

3.1 Expliquer pourquoi le coefficient stœchiométrique dans l'équation support du titrage vaut 3 pour les ions hydroxyde.
3.2 En expliquant votre démarche, déterminer la valeur VE du volume de solution d'hydroxyde de sodium versée à l'équivalence.
3.3 Quel indicateur coloré pourrait-on utiliser pour réaliser ce titrage sans pH-mètre ? Préciser alors comment serait repéré le volume de solution d’hydroxyde de sodium versé à l'équivalence.
3.4 En exploitant les résultats expérimentaux de l'analyse :
- montrer que le détartrant ne peut pas être de l'acide citrique monohydraté ;
- déterminer le pourcentage massique d'acide citrique anhydre du détartrant ;
- conclure sur la pureté du détartrant.
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n'a pas abouti. La démarche est évaluée et nécessite d’être correctement présentée.
|