|
Les huiles essentielles furent, dès l'antiquité, a l'origine des parfums et des saveurs. Par exemple, l'huile essentielle d'anis étoilé ou badiane entre dans la composition de boissons anisées. Une huile essentielle est un liquide d'apparence huileuse d'une couleur variable selon les plantes utilisées. Elle s'obtient généralement par hydrodistillation.
L'hydrodistillation de l'anis étoilé sec produit de 8 à 9 % en masse d'huile essentielle. L'huile essentielle d'anis étoilé contient 80 à 90 % en masse d'anéthol, espèce chimique responsable de l'odeur et du goût de l'anis. Elle contient en faible quantité un autre isomère, l'estragol.
Dans cet exercice on se propose :
- d'étudier les structures des molécules d'anéthol et d'estragol ;
- d'étudier l'extraction par solvant de l'anéthol de l'anis étoilé et la synthèse de l'anéthol ;
- de déterminer la concentration massique d'anéthol dans une boisson anisée.
Données à 25°C :
Solvant →
Propriétés ↓ | Eau | Ethanol | Dichlorométhane | Cyclohexane |
| Miscibilité de l'anéthol | très peu soluble | soluble | soluble | peu soluble |
| Miscibilité de l'éthanol | miscible en toute proportion | | miscible | non-miscible |
| Miscibilité du dochlorométhane | non-miscible | miscible | | miscible |
| Masse volumique (g.mL"') | 1,0 | 0,79 | 1,33 | 0,78 |
| Pictogrammes de sécurité | |  | 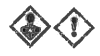 |  |
| Espèce chimique | Masse molaire (g·mol-1) | Masse volumique (g·mL-1 ) |
| anéthol | 148,0 | 0,9882 |
Électronégativlté de quelques atomes selon l'échelle de Pauling :
Données RMN
| CH3-C | CH3-O | CH3-C=C | Ar-H | CH2-C | R-CH=C |
| δ (ppm) | 0,9 | 3,3 - 4,0 | 1,5 - 1,9 | 6,0 - 8,5 | 4,5 - 5,5 | 4,8 - 6,0 |
Ar symbolise un cycle aromatique de formule brute C6H5,c'est-à-dire comportant des doubles liaisons conjuguées.
On rappelle que le pourcentage massique d'une espèce dans un mélange est le rapport de sa masse sur celle du mélange.
1. Les molécules d'anéthol et d'estragol
Les formules semi-développées de l’anéthol et de l'estragol sont représentées ci-dessous :
| Anéthol | Estragol |
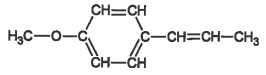 | 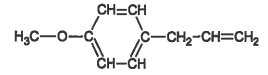 |
1.1. L'anéthol et l'estragol sont deux isomères. Justifier.
1.2. Panni l’anéthol ou I'estragol, lequel présente des stéréoisomères de configuration ? Représenter ces deux stéréoisomères et préciser leur configuration.
1.3. Quelle relation de stéréoisomérie lie ces stéréoisomères ?
1.4. Peut-on différencier facilement ces deux stéréoisomères au laboratoire ? Justifier.
2. Extraction et analyse de l’anéthol Issu de l'anis étoilé
Protocole expérimental
50,0 g d'anis étoilée sont écrasés à l'aide d'un pilon dans un mortier. Sous la hotte, mettre le solide obtenu dans un erlenmeyer et ajouter 200 mL de dichlorométhane. Boucher et agiter pendant 30 minutes. Filtrer puis rincer le filtre avec un peu de dichlorométhane. Transvaser le filtrat dans une ampoule à décanter contenant 200 mL d'eau distillée. Agiter et laisser décanter. Récupérer la phase comportant l'anéthol dans un erlenmeyer. Ajouter 2 à 3 pointes de spatule de sulfate de sodium anhydre. Filtrer et évaporer le solvant sous pression réduite. Peser.
2.1. Schématiser l'ampoule à décanter et identifier les différentes phases en précisant les espèces chimiques présentes.
2.2. Quelles précautions doit-on prendre pendant cette expérience ? Expliquer.
2.3. Sur quels critères est choisi le solvant d'extraction ?
2.4. Quel est le rôle de l'ajout du sulfate de sodium anhydre ?
2.5. On dispose au laboratoire d'un échantillon d'anéthol pur. Proposer une technique d'analyse pour s'assurer de la présence d'anéthol dans le filtrat et indiquer les résultats attendus si l’anéthol est bien présent dans le filtrat.
2.6.A partir de 50,0 g d'anis étoilé, on récupère 1,90 mL d'huile essentielle. L'anéthol est le principal constituant de cette huile essentielle. En négligeant les autres composés. déterminer le pourcentage massique de l’anéthol dans l'anis étoilé. Commenter le résultat.
3. Synthèse de l’anéthol
L'extraction de l’anéthol à partir de l'anis étoilé n'est pas suffisante pour satisfaire la demande des consommateurs. Une voie de synthèse possible est réalisée à partir du phénol. Les différentes étapes de cette synthèse sont données ci-dessous :
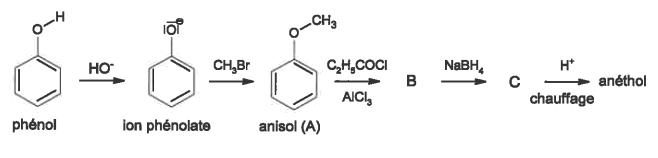
3.1. Quel est le rôle des ions hydroxyde HO- dans la première étape de la synthèse ? En déduire la nature de la réaction mise en jeu dans cette étape.
3.2. La deuxième étape de cette synthèse peut étre modélisée par un mécanisme en une étape représentée ci-dessous.
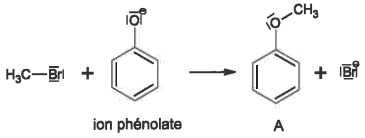
La recopier, indiquer et justifier le site donneur et le site accepteur de doublets d'électrons des entités réactives puis compléter le mécanisme par une ou plusieurs flèches courbes en rappelant leur signification.
3.3. À l'issu des 5 étapes de la synthèse, le produit final obtenu est analysé par spectroscopie RMN du proton. Le spectre obtenu comporte les signaux suivants :
- Singulet intégrant pour 3H vers 3,8 ppm
- Doublet intégrant pour 3H vers 1,9 ppm
- Massif intégrant pour 4H du cycle aromatique (Ar) vers 7 ppm
- Multiplet intégrant pour 1H vers 5.5 ppm
- Multiplet intérant pour 1H vers 6 ppm
Ce spectre confirme-t-il ou non que le produit final est bien de l'anéthol ?
4. Vérification du pourcentage massique d'anéthol dans une boisson anisée alcoolisée
Sur l'étiquette d'une bouteille alcoolisée anisée, on peut lire l'indication suivante : « Anéthol : 0,2 % en masse ». On considère que la densité de cette boisson est de 1,0 à 25°C. Pour déterminer la concentration massique en anéthol de cette boisson, on réalise un dosage par étalonnage. Pour ce faire :
- On réalise dans des fioles jaugées de 50,0 mL une gamme de 5 solutions d'anéthol de concentration molaire différente à partir d'une solution notée (An) d'anéthol dans de l’éthanol, à la concentration de 0,132 mol·L-1.
- on dilue la boisson anisée 50 fois dans de l'éthanol : la solution est notée S.
| Fiole jaugée | 1 | 2 | 3 | 4 | 5 |
| Volume (An) en μL | 50 | 100 | 150 | 200 | 250 |
| Éthanol | En quantité suffisante pour compléterjusqu'au trait de jauge |
On mesure l'absorbance des solutions de la gamme étalon ainsi que celle de la solution S au maximum d'absorption de l'anéthol, soit à une longueur d'onde de 260 nm.
4.1. À quel domaine de rayonnement électromagnétique cela correspond-il ?
4.2. Justifier en analysant la structure de l'anéthol que le maximum d'absorption correspond à cette gamme de longueur d'onde.
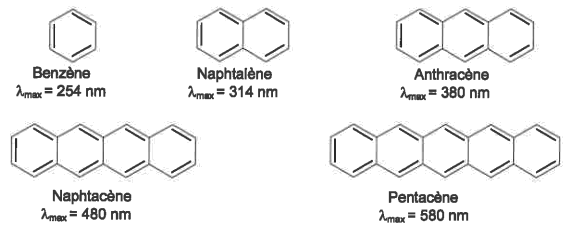
Document : espèce chimique conjuguée et longueurs d'onde des maxima d'absorption
Plus le nombre de liaisons conjuguées est important dans une espèce chimique, plus le maximum d'absorption de cette espèce chimique correspond à un longueur d'onde élevée.
Les valeurs des absorbances des solutions étalons ont été reportées sur la courbe A = f(C) représentée ci-dessous. La solution S présente une absorbance A(S) = 0,80.
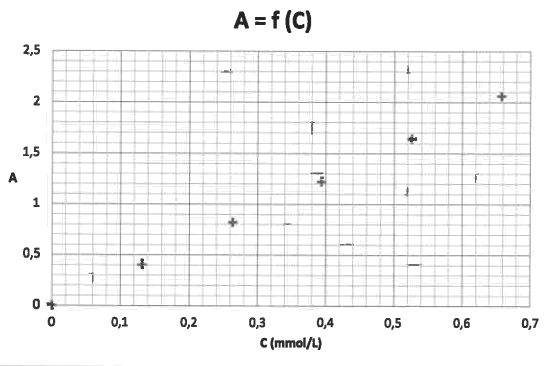
4.3. L'indication du fabricant apposée sur l'étiquette est-elle correcte ?
Le candidat est invité à prendre des initiatives et à présenter la démarche suivie, même si elle n'a pas abouti. La démarche est évaluée et nécessite d'être correctement présentée.
|