|
La méthanisation est une technique mise en œuvre dans des méthaniseurs où le processus naturel biologique de dégradation de la matière organique en absence d'oxygène est accéléré et entretenu pour produire un méthane utilisable (biogaz, dénommé biométhane après épuration). On cherche à atteindre trois objectifs complémentaires : produire de l'énergie, réduire la charge polluante des déchets et des effluents et également, selon la nature du produit de départ, produire un digestat utilisable comme fertilisant ou amendement organique.
1. Maintien à température du digestat
Une partie du méthane produit est utilisée pour chauffer le méthaniseur lui-même. La température doit être maintenue à une valeur proche de 38°C de façon à optimiser la méthanisation.
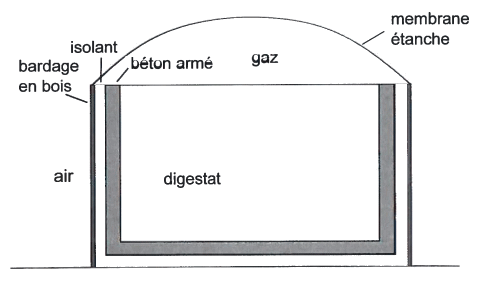
Le méthaniseur est assimilable à un cylindre en béton armé, d’épaisseur e1= 30 cm, d'un diamètre D = 10,0 m et d'une hauteur h = 5,0 m. Il est isolé par l’extérieur avec du polystyrène d'épaisseur e2 = 15 cm. Un bardage en bois d’épaisseur e3 = 2,0 cm protège le dispositif des intempéries. La poche de biogaz au sommet de l'ensemble est retenue par une membrane étanche, comme le montre le schéma ci-dessus.
Données :
La résistance thermique Rth, d'une paroi plane est donnée par la relation \(\displaystyle\mathrm{R_{th}= \frac{e}{λ \ S} } \) où e est l'épaisseur de la paroi (en m), S la surface d'échange en m2 et λ la conductivité thermique de la paroi (en W·m-1·K-1). La surface latérale d'un cylindre de diamètre D et de hauteur h est donnéepar S = π D h. Valeurs de conductivité thermique :
| Matériaux | Béton armé | Polystyrène extrudé | Bois (bardage) |
Conductivité thermique λ
en W·m-1·K-1 | 1,65 | 0,038 | 0,20 |
Les résistances thermiques de parois accolées s'additionnent. Le flux thermique φ d’un milieu 2 de température T2 à un milieu 1 de température T1 à travers une paroi de résistance thermique Rth, est donné par la relation \(\displaystyle\mathrm{φ= \frac{T_1-T_2}{R_{th}} } \) où φ est exprimé en W, Rth en unité du système international, T1 et T2 en K.
1.1. Déterminer le mode de transfert thermique à travers les parois latérales du méthaniseur.
1.2. On suppose que le diamètre du méthaniseur est suffisamment grand par rapport à l'épaisseur de la paroi pour pouvoir considérer que la résistance thermique de la partie verticale séparant le digestat de l'air est égale à celle d'une paroi plane de même constitution et de même surface. Vérifier que la résistance thermique totale de la paroi verticale Rtotale est égale à 2,7·10-2 S.l. Préciser son unité.
1.3. On considère la température de l’air égale à sa valeur moyenne annuelle en France, soit 10°C .
1.3.1.Représenter le flux thermique φ à travers la paroi verticale du méthaniseur par une flèche sur le schéma ci-dessous, à reproduire sur la copie. Justifier.

1.3.2. Calculer la valeur du flux thermique qui traverse cette paroi verticale.
1.4. Un méthaniseur de cette taille peut produire 750 000 m3 de biogaz chaque année. L'énergie que peut produire 1 m3 de biogaz vaut 21 MJ. Les pertes thermiques de l'installation (flux thermique à travers les parois verticales, le sol et la membrane) sont évaluées à 1,6 kW en moyenne. Comparer la valeur de l'énergie stockée sous forme de biogaz aux pertes thermiques de l'installation. Commenter.
2. Le digestat, un engrais vert
Un agriculteur souhaite remplacer ses apports en engrais « chimique » azoté par un apport en digestat dont la quasi-totalité de l'azote se trouve sous la forme d'ammoniac (NH3) dissous. Il demande donc à un laboratoire d'analyser le digestat de manière à connaître sa teneur en azote N.
Pour cette analyse, 1 kg de digestat est chauffé et brassé. L'ammoniac issu du digestat est recueilli puis dissous dans de l'eau acidifiée, comme le montre le schéma ci-dessous :

Données :
- Masses molaires : M(H) = 1,0 g·mol-1 ; M(N) = 14,0 g·mol-1 ; M(O) = 16,0 g·mol-1
- Couples acide / base et pKA :
- ion ammonium / ammoniac (NH4+/ NH3), pKA = 9,2
- eau / ion hydroxyde(H2O / HO-), pKA = 14,0
Lorsque la totalité de l'ammoniac s'est échappée du digestat, on recueille l'intégralité de la solution S formée, de volume Vs = 2,0 L. On mesure le pH de la solution S : il est voisin de 5.
2.1.En s'appuyant sur le diagramme de prédominance du couple ion ammonium/ammoniac, identifier l'espèce azotée majoritaire dans la solution S.
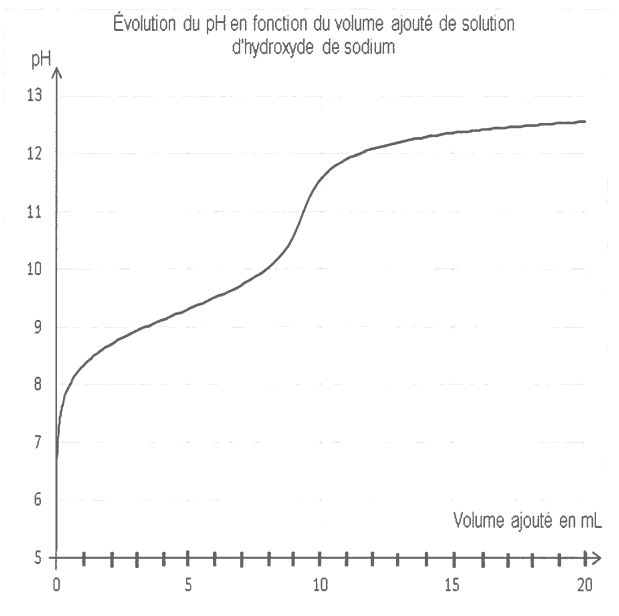
2.2. On dose un volume V = 10,0 mL de solution S par une solution d'hydroxyde de sodium (Na+(aq), HO-(aq)) de concentration molaire Cb = 0,10 mol·L1. Le suivi pH-métrique permet d'obtenir la courbe fournie en annexe à rendreavec la copie.
2.2.1. Écrire l'équation de la réaction support du dosage de l'ion ammonium par la solution d'hydroxyde de sodium. On suppose que seule cette réaction se produit lors du dosage.
2.2.2. Le laboratoire indique sur la fiche de synthèse de l'analyse une teneur en azote N égale à 2,6 g par kilogramme de digestat. Cette teneur est-elle cohérente avec le suivi pH-métrique réalisé et donné en annexe à rendre avec la copie ? La démarche suivie devra être détaillée.
2.3. L'agriculteur utilisait précédemment un engrais de synthèse, le nitrate d'ammonium NH4NO3. Après avoir calculé la masse d'azote N dans une mole de nitrate d'ammonium NH4NO3, comparer les apports en azote du digestat et de cet engrais de synthèse puis donner un avantage et un inconvénient de la valorisation du digestat comme engrais.
|