Carnet de bac
Annales
Synthèse verte du phénol |
|
| Métropole 2014 (remplacement) - Exercice 1 - 5 points |
|
Le phénol (C6H5OH) est un composé d'une grande importance en chimie organique industrielle car il est l’un des intermédiaires de nombreuses réactions comme celle de la synthèse de l'aspirine. Nous allons nous intéresser dans cet exercice à la synthèse du phénol en comparant deux procédés du point de vue de la chimie verte.
|
|||||||||||||||||
|
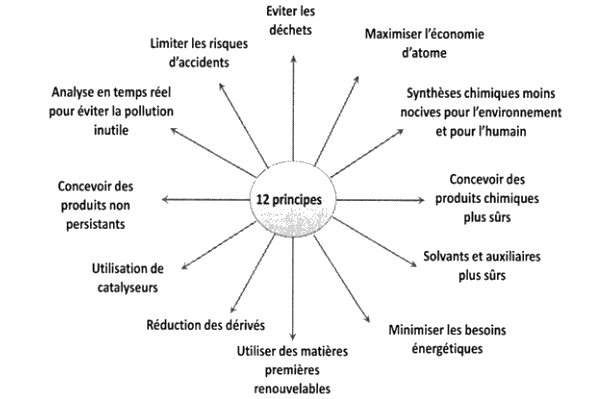
Document 1. Les 12 principes fondamentaux de la chimie verte
|
|||||||||||||||||
|
Document 2. L'économie d'atomes
L'efficacité d'un procédé est traditionnellement mesurée par le rendement chimique, sans tenir compte de la quantité de sous-produits formés. Dans une optique de réduction de la pollution à la source, la chimie verte propose une évolution du concept d'efficacité qui prend en compte la minimisation de la quantité de déchets. On utilise comme indicateur de l'efficacité d'un procédé son économie d’atomes (ou utilisation atomique). L’Économie d'Atomes (EA) d’une synthèse est définie comme le rapport de la somme des masses molaires du (ou des) produit(s) recherché(s) sur la somme des masses molaires de tous les réactifs en tenant compte des coefficients stœchiométriques : $$ \mathrm{ EA=\frac{\sum a_i \ M_i (produits \ désirés)}{\sum b_i \ M_i (réactifs \ utilisés)} }$$ $$ \mathrm{ EA= \frac{a_1 \ M_1 (produit \ 1)+a_2 \ M_2 (produit \ 2)+...}{b_1 \ M_1 (réactif \ 1)+b_2 \ M_2 (réactif \ 2)+...} }$$ avec ai et bi les coefficients stœchiométriques et Mi les masses molaires des espèces chimiques. Par ailleurs, il est capital de remarquer qu’un procédé vert n'est pas seulement un procédé moins polluant, il permet également au fabricant de réduire ses dépenses. D'après le site internet : Culturesciences |
|||||||||||||||||
|
Document 3. Deux procédés de synthèse du phénol
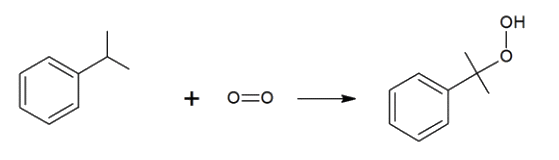
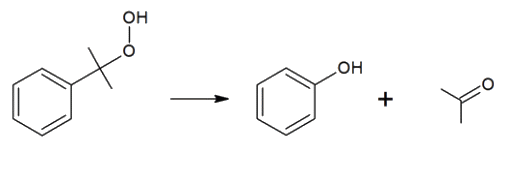
Procédé N°1 dit procédé au cumène :
Étape 2 : réalisée à une température d'environ 110°C, sous une pression de 5 à 10 bar, en milieu basique.
Étape 3 : réalisée à 50°C en milieu légèrement acide.
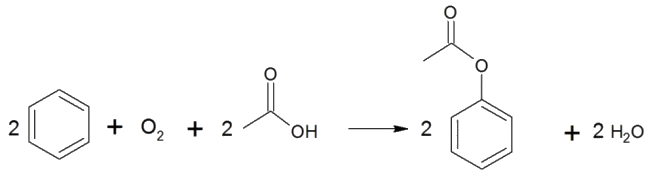
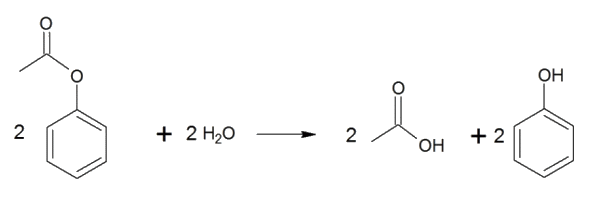
Procédé N°2 : Ce second procédé en deux étapes est notamment étudié par la firme Mitsubishi Chemical. Étape 1 : acétoxylation du benzène en présence d'air et d'acide éthanoïque, étape catalysée par du palladium et réalisée à environ 200°C.
Étape 2 : Hydrolyse du produit obtenu réalisée à 600°C
D'après : Procédés de pétrochimie: les grands intermédiaires oxygénés, chlorés et nitrés
|
|||||||||||||||||
|
1. Quelle valeur maximale l'économie d'atomes EA peut-elle atteindre ? Justifier simplement.
| |||||||||||||||||