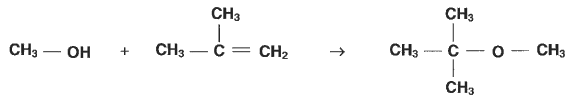Carnet de bac
Annales
Quelques alcools de l'industrie chimique |
|
| Liban 2014 - Exercice 3 - 5 points |
|
Les alcools se forment naturellement par fermentation de certaines solutions sucrées : le jus de raisin se transforme ainsi en éthanol lors de la fabrication du vin par exemple. Dans l’industrie chimique, bien d’autres procédés conduisent à la production d’alcools, qui seront eux-mêmes à la base de la fabrication de nombreux produits : solvants, polymères, détergents …
|
||||||||
|
Document 1 : Production et usages du méthanol
Le méthanol est un liquide incolore et inflammable ; il est miscible à l’eau, aux alcools, aux esters et à la plupart des autres solvants organiques. Pour produire du méthanol, l’hydrogénation du dioxyde de carbone est la voie la plus étudiée actuellement. Ce procédé peut être modélisé par la réaction chimique dont l’équation est :
CO2 + 3 H2 → méthanol + H2O
D’après un rapport réalisé pour l’ADEME, juin 2010 |
||||||||
|
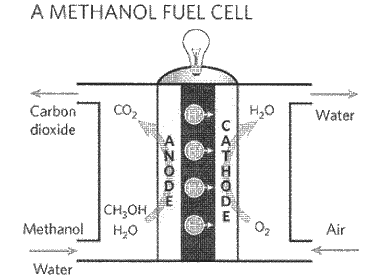
Document 2 : Schéma d'une pile à combustible au méthanol
|
||||||||
1.1. Le tableau suivant donne les électronégativités des atomes H, C et O dans l’échelle de Pauling.
Justifier le caractère polaire de la molécule de méthanol.
(a) CH3OH + H2O = CO2 + 6 H+ + 6 e–
|
||||||||
|
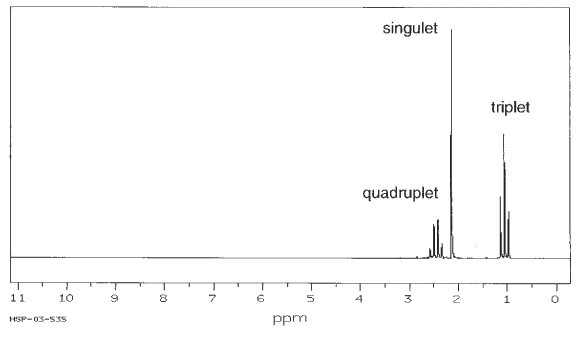
Document 3 : Spectroscopie RMN du proton
| ||||||||