Carnet de bac
Annales
Nettoyage en archéologie |
|
| Amérique du sud 2014 - Exercice 2 - 7 points |
|
Les parties 1. et 2. sont totalement indépendantes.
|
|
Document 1 : notice simplifiée d’un appareil de nettoyage à ultrasons
Descriptif :
Référence : nettoyeur à ultrasons CD-3900 |
|
1. Étude des ultrasons
Données :
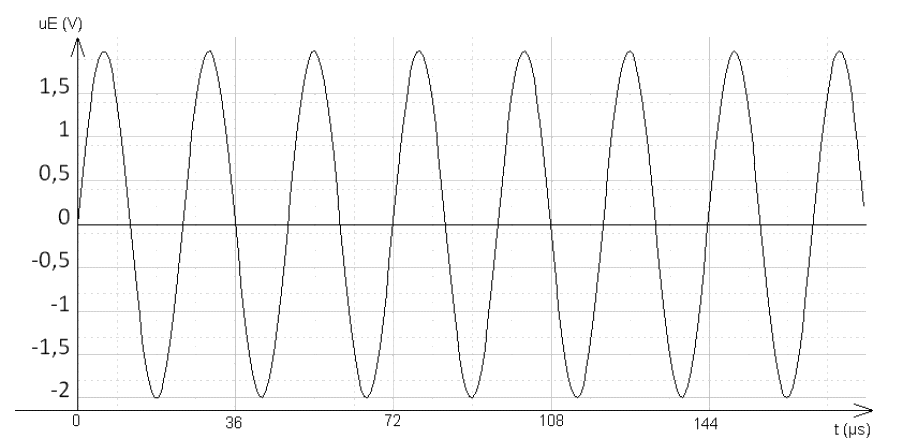
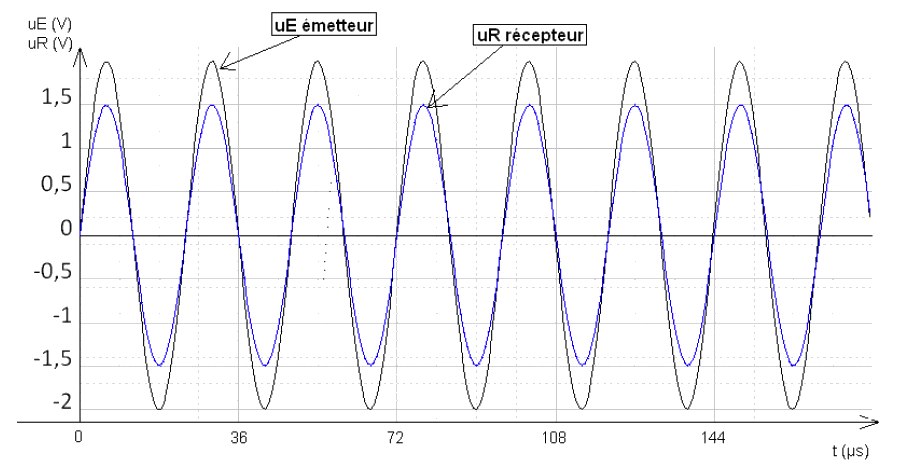
On souhaite étudier les ultrasons émis par l’appareil décrit dans le document 1. Pour cela, on isole l’émetteur E à ultrasons de cet appareil et on visualise le signal émis à l’aide d’un capteur relié à la voie 1 d’un oscilloscope. Les mesures sont faites dans l’air à la température de 20 °C. On obtient le signal uE suivant :
1.1. Déterminer la période T du signal représenté sur la figure 1. Expliquer la méthode.
1.3.1. Définir la valeur de la longueur d’onde λ.
|
|
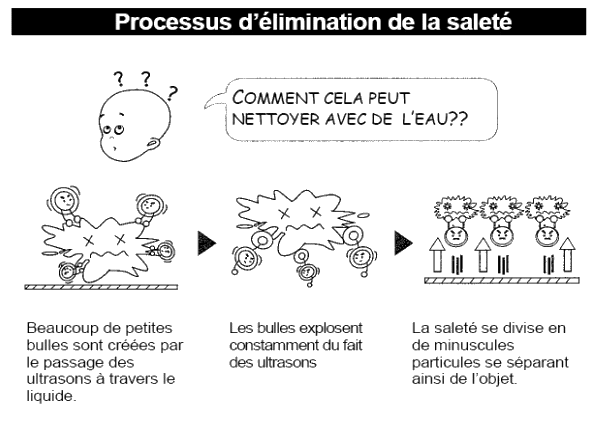
Document 2 : Comment cela fonctionne ?
Le bain à ultrasons est composé d’une cuve contenant de l’eau dans lequel sont plongées les pièces à nettoyer. Sur les parois, un transducteur à ultrasons génère des phases successives de compression et dépression dans le liquide qui se propagent de proche en proche dans le liquide. Des microbulles apparaissent, on appelle ce phénomène la « cavitation acoustique ». L’implosion1 de ces bulles, pendant la phase de compression, crée des turbulences qui détachent les impuretés de la pièce à nettoyer.
|
|
2.1. Les ondes ultrasonores sont-elles des ondes mécaniques ?
|