Carnet de bac
Annales
Les débuts de l'électron en physique |
|
| Liban 2014 - Exercice 2 - 9 points |
Le problème posé par la nature des « rayons cathodiques » à la fin du XIXème siècle fut résolu en 1897 par l'Anglais J.J. Thomson : il s'agissait de particules chargées négativement baptisées par la suite « électrons ». La découverte de l'électron valut à Thomson le prix Nobel de physique en 1906.
2. L'expérience de Millikan L'objectif de Millikan est de montrer qu'un corps chargé ne peut porter qu'une charge électrique multiple d'une « charge élémentaire ». |
||||||||||||||||||||||||||||||
|
Document 1 : Principe de l'expérience menée en 1910 par Millikan
Millikan pulvérise des gouttelettes d'huile chargées par irradiation entre deux plaques planes où règne un champ électrique et les observe à l'aide d'un microscope. Sa méthode consiste à immobiliser les gouttelettes en augmentant le champ électrique jusqu'à ce que le poids de la gouttelette soit compensé par la force électrostatique. Millikan parvint ainsi à obtenir une valeur approchée de la charge élémentaire e = 1,591·10−19 C, très proche de la valeur admise aujourd'hui. |
||||||||||||||||||||||||||||||
|
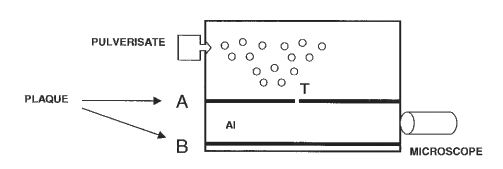
Document 2 : Description d'une expérience menée de nos jours en laboratoire
Un pulvérisateur produit un nuage de gouttelettes d'huile chargées négativement qui tombent dans la chambre supérieure du dispositif. Lorsque l'une d'elles passe à travers le trou T, elle tombe verticalement à une vitesse constante v1, son poids étant très vite compensé par la force de frottement exercée par l'air. Lors de cette première étape, la chute verticale de la gouttelette dans l'air en l'absence de champ électrique est observée à l'aide d'un microscope et permet de déterminer le rayon r de la gouttelette qui n'est pas mesurable directement. Lors d'une deuxième étape, lorsque la gouttelette parvient en bas du dispositif, un champ électrique uniforme est créé entre les plaques A et B. La gouttelette remonte alors verticalement à une vitesse constante v2. La charge électrique portée par la gouttelette est ensuite déduite des mesures des vitesses v1 et v2. |
||||||||||||||||||||||||||||||
Lors de l'expérience menée au laboratoire, une gouttelette de masse m et de charge q négative arrive entre les plaques A et B. La poussée d'Archimède est négligée. La gouttelette étudiée est soumise à son poids \(\displaystyle \mathrm{ \vec{P} }\) et à la force de frottement \(\displaystyle \mathrm{ \vec{f} }\) exercée par l'air s'exprimant par la relation \(\displaystyle \mathrm{ \vec{f}= -6 \ π \ η \ r \ \vec{v} }\) dans laquelle η est la viscosité de l'air, r le rayon de la gouttelette et sa vitesse \(\displaystyle \mathrm{ \vec{v} }\).
2.1. Chute verticale de la gouttelette
|
||||||||||||||||||||||||||||||
Document 3 : Mesures de v1 et v2 pour différentes gouttelettes
|
||||||||||||||||||||||||||||||
2.2.1. Les gouttelettes n°2 et n°5 du document 3 ont la même vitesse de descente v1 mais des vitesses de remontée v2 différentes. Déterminer sans calcul le rayon de la gouttelette n°5. Justifier. Pourquoi leurs vitesses de remontée sont-elles différentes ?
|
||||||||||||||||||||||||||||||
| Annexe | |
|
Sens de \(\displaystyle \mathrm{ \vec{F}_e }\) : Sens de \(\displaystyle \mathrm{ \vec{E} }\) : | |