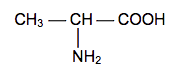Carnet de bac
Annales
L'homochiralité du vivant |
|
| Polynésie 2014 - Exercice 3 - 5 points |
|
L’homochiralité du vivant est étroitement liée à la synthèse des protéines, elle-même maillon indispensable à la vie. L’objectif de l’exercice est d’étudier l’origine de cette homochiralité.
|
|
Document 1
La nature a une « droite » et une « gauche » et sait les différencier. Il existe de nombreux exemples d’asymétrie dans la nature : les êtres humains ont l’estomac à gauche et le foie à droite. Les coquilles d’escargots forment généralement une hélice droite. Mais quelques bigorneaux présentent un enroulement gauche ! Au niveau moléculaire, on constate que, dans la nature, les réactions de synthèse conduisent à la formation d’un seul des deux énantiomères d’une molécule. Au sein du vivant, les acides aminés n’existent que sous forme « gauche » et les sucres sous une forme « droite ». C’est ce que l’on appelle l’homochiralité du vivant. D'après le site ac-nancy-metz |
|
Document 2
Historiquement, il existe deux grandes théories : la théorie biotique et la théorieabiotique.
D’après l’interview de Laurent Nahon, chercheur, La Recherche
|
|
Document 3
Les chercheurs ont tout d’abord reproduit en laboratoire des échantillons de « glace » interstellaire et cométaire. Principale originalité de leur expérience : les glaces ont été soumises à un rayonnement ultra-violet polarisé censé reproduire les conditions rencontrées dans certains milieux interstellaires. Lors du réchauffement de ces « glaces », un résidu organique, soluble dans l’eau, s’est formé. Une analyse fine de cette substance a révélé qu’elle contenait un excès d’énantiomère « gauche » significatif d’un acide aminé chiral, l’alanine. Supérieur à 1,3 %, cet excès est comparable à celui mesuré dans les météorites primitives. D’après Heligreen.net |