|
À la fin du XVIe siècle, beaucoup de marins succombaient au scorbut. Cette mortalité était due à une carence en vitamine C aussi appelée « acide ascorbique ». Il s’agit d’un acide organique ayant entre autres des propriétés anti-oxydantes. Il est présent dans les citrons, les jus de fruits et les légumes frais. Le nom « ascorbique » vient du préfixe grec a (privatif) et de scorbut, signifiant littéralement anti-scorbut. La vitamine C intervient dans de nombreuses réactions d’oxydo-réduction dans l’organisme, dans le métabolisme du fer et des acides aminés.
Nous allons dans une première partie nous intéresser à la molécule d’acide ascorbique. Dans une deuxième partie, nous verrons une méthode de titrage par suivi pH-métrique d’un comprimé de vitamine C. La troisième partie sera consacrée à d’autres méthodes de titrage.
1. La molécule d’acide ascorbique
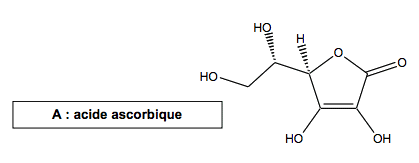
1.1. Reproduire la molécule A sur votre copie et marquer d’un astérisque le (ou les) atomes de carbone asymétrique(s) présent(s).
1.2. La molécule A est-elle chirale ? Justifier.
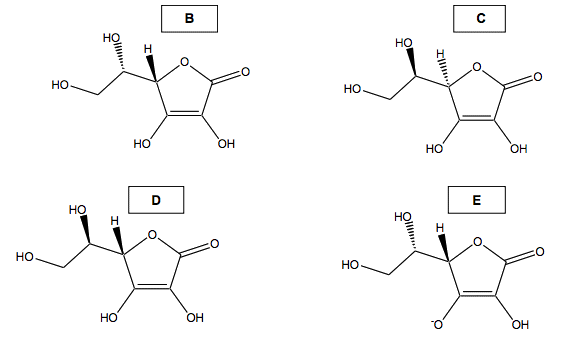
1.3. Quelle est la relation entre A et B (espèces identiques, isomères, formant un couple acide/base ou un couple oxydant/réducteur) ? En cas d’isomérie, préciser la relation d’isomérie. Comparer de même A aux espèces C, D et E. Justifier les réponses.
1.4. Déterminer la formule brute de l’acide ascorbique.
2. Titrage de l’acide ascorbique par suivi pH-métrique
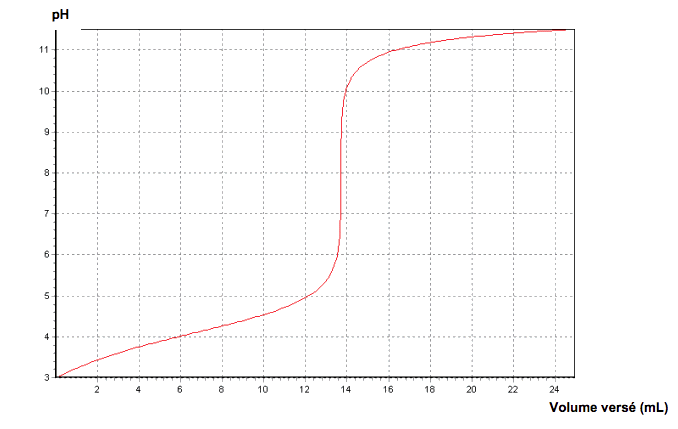
On souhaite vérifier l’indication figurant sur une boîte de comprimés de vitamine C vendue en pharmacie : le fabricant annonce que la masse d’acide ascorbique est de 500 mg par comprimé. Un comprimé de vitamine C est écrasé dans un mortier. La poudre est ensuite dissoute dans une fiole jaugée de 200,0 mL que l’on complète avec de l’eau distillée jusqu’au trait de jauge en homogénéisant le mélange. On obtient la solution S. On prélève 10,0 mL de cette solution que l’on titre avec une solution d’hydroxyde de sodium (Na+(aq) + HO–(aq)) de concentration molaire 1,00·10–2 mol·L-1. On suit le titrage par pH-métrie. Le graphique représentant l’évolution du pH en fonction du volume de solution d’hydroxyde de sodium versé est représenté en annexe.
L’acide ascorbique sera noté AH dans la suite de l’exercice.
2.1. L’ion hydroxyde est une base forte en solution aqueuse. Déterminer le pH de la solution d’hydroxyde de sodium utilisée pour le titrage. En déduire les précautions qu’il convient d’adopter pour utiliser cette solution.
2.2. Réaliser un schéma annoté du montage expérimental nécessaire à la mise en œuvre du titrage.
2.3. Écrire l’équation de la réaction support du titrage.
2.4. À partir du protocole mis en œuvre et des résultats obtenus, déterminer la masse d’acide ascorbique contenue dans le comprimé.
2.5. Préciser les sources d’erreurs possibles. Calculer l’écart relatif entre la masse théorique et la masse expérimentale. Commenter la valeur obtenue.
2.6. D’après les résultats obtenus, peut-on savoir si l’acide ascorbique est un acide fort ou un acide faible ? Justifier la réponse.
3. Autres méthodes de titrage
Le titrage de l’acide ascorbique peut également se faire par d’autres techniques. Nous allons dans cette partie étudier succinctement deux : l’utilisation d’un indicateur coloré et le suivi conductimétrique.
3.1. Utilisation d’un indicateur coloré.
Parmi les indicateurs colorés proposés, lequel utiliseriez-vous pour le titrage de l’acide ascorbique par la solution d’hydroxyde de sodium effectué dans la partie 2 ? Justifier la réponse et préciser comment l’équivalence est repérée.
| Indicateur coloré |
Teinte acide |
Zone de virage |
Teinte basique |
| Hélianthine |
Rouge |
3,1 – 4,4 |
Jaune |
| Vert de bromocrésol |
Jaune |
3,8 – 5,4 |
Bleu |
| Bleu de bromothymol |
Jaune |
6,0 – 7,6 |
Bleu |
| Rouge de crésol |
Jaune |
7,2 – 8,8 |
Rouge |
| Phénolphtaléine |
Incolore |
8,2 – 10,0 |
Rose |
| Rouge d’alizarine |
Violet |
10,0 – 12,0 |
Jaune |
| Carmin d’indigo |
Bleu |
11,6 – 14,0 |
Jaune |
3.2. Titrage conductimétrique.
On envisage d’effectuer le titrage conductimétrique d’une solution S’ d’acide ascorbique dont la concentration molaire est de l’ordre de 6·10-3 mol·L-1 par une solution d’hydroxyde de sodium de concentration c’B = 1,00·10-1 mol·L-1. On dispose de pipettes jaugées de 10,0 mL, 20,0 mL et 25,0 mL ainsi que de fioles jaugées de 50,0 mL, 100 mL, 200,0 mL et 250,0 mL.
3.2.1. Expliquer pourquoi il n’est pas pertinent de titrer la solution d’acide ascorbique S’ par la solution d’hydroxyde de sodium de concentration molaire c’B.
3.2.2. À partir des réactifs proposés, établir un protocole expérimental permettant d’effectuer le titrage conductimétrique en précisant :
• les éventuelles adaptations effectués au niveau des concentrations ;
• le volume de solution d’acide ascorbique prélevé.
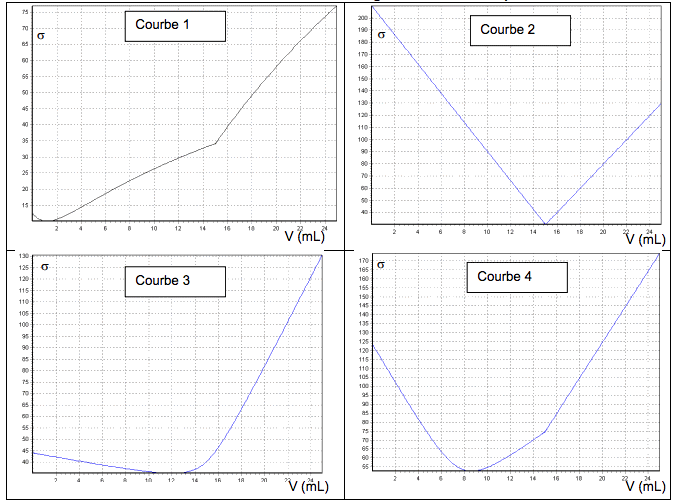
3.2.3. Plusieurs allures de courbes modélisant ce titrage sont proposées ci-dessous. En argumentant, identifier la courbe qui peut correspondre au titrage conductimétrique de l’acide ascorbique par la solution d’hydroxyde de sodium.
Allures de courbes de titrages conductimétriques.
Données :
- pKe = 14,0 à 25 °C
- Masses molaires atomiques : M(H) = 1,0 g·mol-1 ; M(C) = 12,0 g·mol-1 ; M(O) = 16,0 g·mol-1
- Conductivités molaires ioniques à 25 °C : λ(HO–)=19,8 mS·m2·mol-1 ; λ(Na+)=5,01 mS·m2·mol-1 ; λ(ion ascorbate A-)=2,5 mS·m2·mol-1.
|