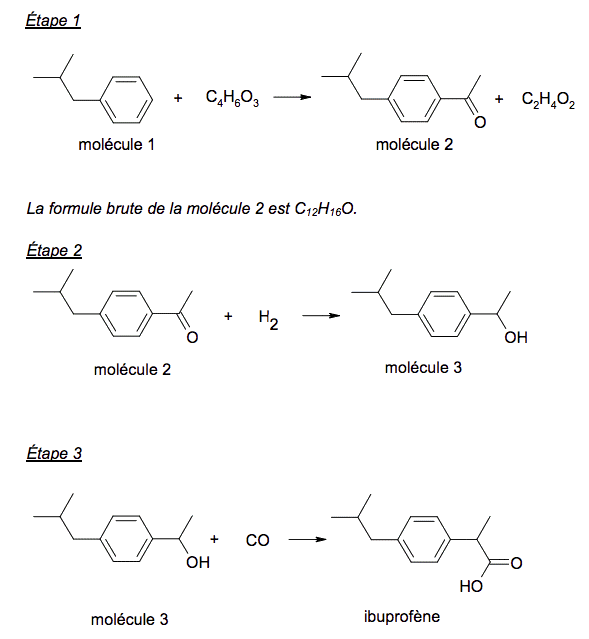Carnet de bac
Annales
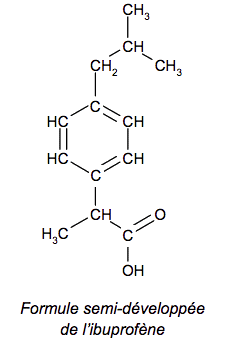
Molécule d'ibuprofène |
|
| Pondichéry 2013 - Exercice 2 - 9,5 points |
|
L’ibuprofène est une molécule de formule brute C13H18O2. Son nom en nomenclature officielle est acide 2-(4-isobutylphényl)propranoïque. De par ses propriétés anti-inflammatoire, antalgique et antipyrétique, elle constitue le principe actif de divers médicaments. Cet exercice comporte trois parties indépendantes conduisant à étudier la structure de la molécule d’ibuprofène, sa synthèse dans le cadre de la chimie verte et le dosage d’un médicament.
|
|||||||||||||||||||||||||||||||||||
|
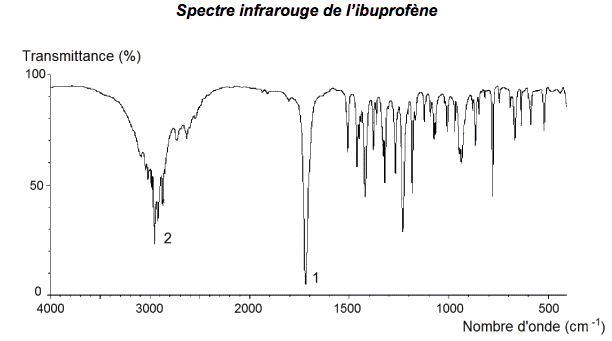
Document 1 : Spectre infrarouge de l’ibuprofène
|
|||||||||||||||||||||||||||||||||||
|
Document 2 : Bandes d’absorption IR de quelques types de liaisons chimiques
| |||||||||||||||||||||||||||||||||||
|
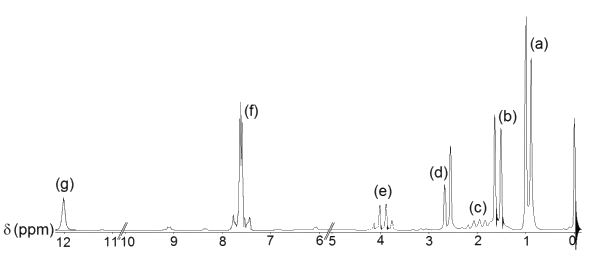
Document 3 : Spectre RMN de l’ibuprofène
L’aire du doublet (a) est environ six fois supérieure à celle du singulet (g), c’est-à-dire que le saut de la courbe d’intégration est six fois plus grand pour (a) que pour (g).
|
|||||||||||||||||||||||||||||||||||
|
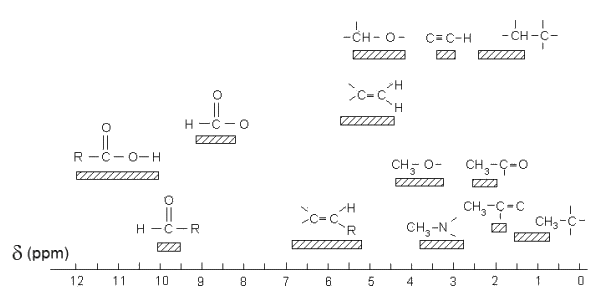
Document 4 : Déplacements chimiques δ en ppm (partie par million)
|
|||||||||||||||||||||||||||||||||||
|
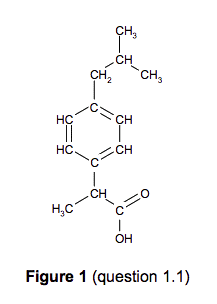
1.3.1. Donner l’origine des bandes d’absorption 1 et 2 du spectre infrarouge IR (document 1) en exploitant les données du document 2.
|
|||||||||||||||||||||||||||||||||||
|
Document 5 : La chimie verte
La chimie verte s’inscrit dans une logique de développement durable et de recherche permanente de sécurité optimale. Pour cela les processus mis en jeu doivent éliminer ou au moins réduire l’utilisation de substances nocives pour l’homme et l’environnement. Les synthèses chimiques doivent privilégier des méthodes produisant le minimum de substances dérivées inutiles, surtout si elles sont polluantes.
|
|||||||||||||||||||||||||||||||||||
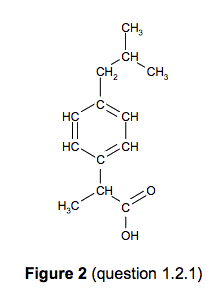
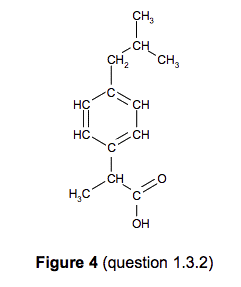
2.1. Le procédé BHC, dont l’utilisation atomique est de 77 %, met en jeu trois étapes faisant appel à des transformations catalysées :
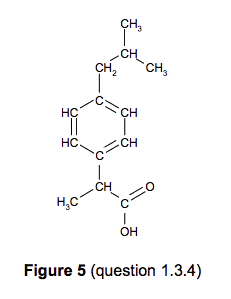
2.1.1. Déterminer la formule brute de la molécule 1.
|
|||||||||||||||||||||||||||||||||||
| Annexe | |||||||
|
| |||||||