Carnet de bac
Annales
Les dangers de l'alcool |
|
| Amérique du sud 2013 - Exercice 2 - 7,5 points |
|
Document 1
On trouve dans un document publié par l'Institut suisse de prévention de l'alcoolisme (ISPA) les informations suivantes :
| ||||||||||||
|
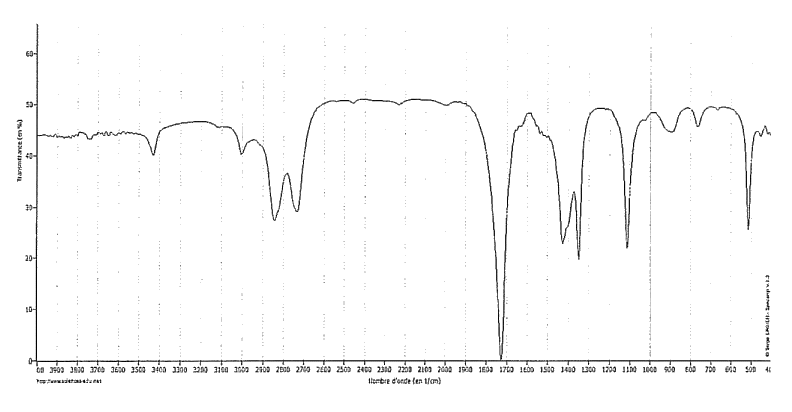
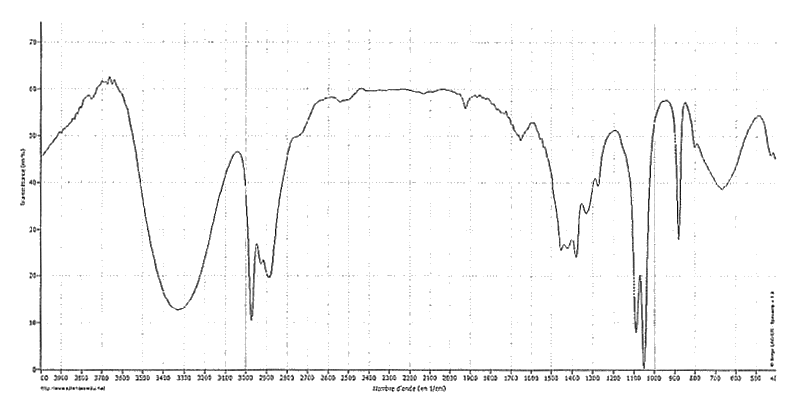
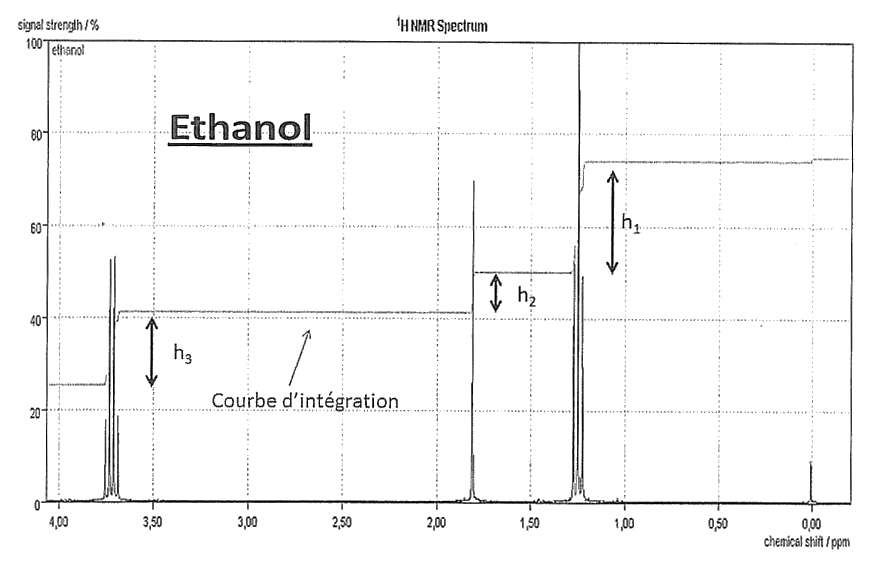
1. Spectroscopie
On se propose d'étudier la structure et les fonctions organiques de ces molécules par spectroscopie.
1.1. Le document 1 évoque les molécules d'éthanol et d'éthanal : représenter en formule semi-développée ces deux molécules et encadrer leurs fonctions caractéristiques.
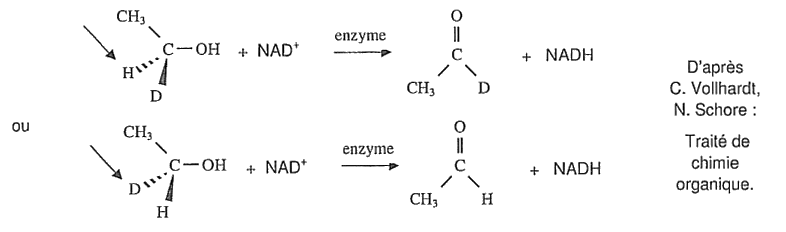
D désigne l'isotope 2 de l'hydrogène \(\displaystyle\mathrm{ _1^1H } \) appelé deutérium.
Ethanol + NAD+ → Ethanal + NADH + H+
Troisième étape : La NADH absorbant dans le domaine UV, on mesure son absorbance par spectrophotométrie. L'étalonnage du spectrophotomètre avec différentes solutions d'éthanol permet de vérifier la loi de Beer-Lambert : A = k Cm avec k = 1,6·10-3 L·mg-1 et Cm la concentration massique d'éthanol dans l'échantillon.
On complète avec de l'eau distillée. L'absorbance mesurée pour cet échantillon vaut : Ae=0,15.
|
||||||||||||